Атом серы образует. Химическая характеристика серы. Добыча серных руд и получение серы
П Л А Н
1. Историческая справка.
2. Физические свойства.
3. Химические свойства.
4. Добыча серных руд и получение серы.
5. Применение серы.
Сера S – химический элемент VI группы переодической системы Мендеева, атомный номер 16, атомная масса 32,064. Твёрдое хрупкое вещество жёлтого цвета.
Историческая справка.
Сера в самородном состоянии, а также в виде соединений, например сульфидов, известна с древнейших времен. Жрецы использовали ее в составе «священных курений» при некоторых религиозных обрядах. Разные горючие смеси для военных целей также содержали серу. Еще у Гомера упоминаются «сернистые испарения» и смертельное действие продуктов горения серы. Она входила в состав «греческого огня», наводившего ужас на противников.
В 941 г. под стенами Царьграда был уничтожен флот киевского князя Игоря. В летописном своде событий «Повесть временных лет», составленном в Киеве, так описан поход Игоря: «Словно молнию... которая на небе, греки имеют у себя и пускали ее, сжигая нас, поэтому мы и не одолели их». Дружинники князя защищались от «греческого огня» щитами, воловьими шкурами, но потерпели поражение. Греки выбрасывали горящую смесь через медные трубы, установленные на бортах византийских кораблей. Состав этой смеси был неизвестен. Греки держали его в секрете. Предполагают, что в нее входили нефть, различные горючие масла, смола, селитра, клен, сера и вещества, которые окрашивали пламя.
Горючесть серы, легкость, с которой она соединяется с металлами, объясняют причину, почему ее считали «принципом горючести» и обязательной составной частью металлических руд. Наивное верование алхимиков о сере выражено в небольшом стихотворении Н. А. Михайловым:
Семь металлов создал свет. Медь, железо, серебро,
По числу семи планет: Злато, олово, свинец...
Дал нам Космос на добро Сын мой! сера им отец!..
В VIII-IX вв. в сочинениях арабских алхимиков рассматривается ртутно-серная теория состава металлов, согласно которой происхождение всех металлов объяснялось сочетанием серы и ртути. Эти воззрения сохранялись в Европе вплоть до XVIII в. Рождение металлов в средние века, конечно, мыслилось при благословении католической церкви, как это и изображено в иллюстрации к книге «Семь ключей мудрости», приписываемой алхимику Базилю Валентину.
Элементарную природу серы установил француз Антуан Лоран Лавуазье (по образованию юрист, а по призванию химик) в своих опытах по сжиганию.
Древнерусское название «сера» употребляется очень давно. По-видимому, оно происходит от санскритского слова «сира», что означает светло-желтый. Но есть и другое древнерусское название серы - «жупел» (сера горючая).
Сера -это порошок желтого цвета. Для нее характерно несколько модификаций, отличающихся друг от друга строением молекул и некоторыми свойствами. Так, ромбическая и моноклиническая сера всегда состоит из восьмиатомных кольцевидных молекул S 8 .
Различие в свойствах кристаллических модификаций серы обусловлено не числом атомов в молекуле, как например в молекулах кислорода и озона, а неодинаковой структурой кристаллов. На рисунке 5 показан внешний вид кристаллов ромбической и моноклинической серы. Ромбическая сера обычно желтого, а моноклиническая бледно-желтого цвета.
Третья модификация серы пластическая. Она состоит из нерегулярно расположенных зигзагообразных цепочек Sn, где п достигает нескольких тысяч. Другие модификации серы построены из молекул S 2 (пурпурная) и S 6 (оранжево-желтая).
Сколько бы аллотропных видоизменений ни образовывал химический элемент, при определенных заданных условиях абсолютно устойчивым из них, как правило, оказывается лишь какое-то одно. Для серы самой устойчивой аллотропной модификацией при обычных условиях при нормальном давлении и температуре не выше 95,6°С является ромбическая сера. В нее при комнатной температуре (или близкой к комнатной) превращаются все другие формы. Например, при кристаллизации из расплава серы сначала получаются игольчатые кристаллы моноклинической формы, которые при температуре ниже 95,6°С переходят в ромбические. При температуре выше 95,6°С устойчива моноклиническая сера.
Подобные превращения происходят и с другими модификациями серы. Так, если расплавленную серу вылить в холодную воду, образуется эластичная, во многом похожая на резину коричневая масса. Переход из одной аллотропной формы в другую сопровождается поглощением теплоты:
S D S - Q кдж
кристал- пласти-
лическая ческая
Такую пластическую серу можно получить в условиях школьной лаборатории. Она неустойчива и через некоторое время станет хрупкой, приобретет желтый цвет, т. е. постепенно будет превращаться в ромбическую.
Физические свойства.
Плавление серы происходит в интервале температур 112-119,3°С (в зависимости от чистоты образца). При этом с увеличением температуры до 155°С вязкость расплава уменьшается и возрастает в тысячи раз в интервале температур 155-187°С. Затем снова наступает спад. На рисунке 10 показано, как изменяется вязкость расплава серы при нагревании. Имеется несколько объяснений этого явления. Одно из них таково, С возрастанием температуры от 155 до 187°С, вероятно, происходит значительный рост молекулярной массы. Кольцевые молекулы Ss разрушаются и образуются другие - в виде длинных цепей из нескольких тысяч атомов. Вязкость расплава увеличивается. При 187°С она достигает величины свыше 90 н сек/м 2 , т. е. почти как у твердого вещества. Дальнейшее повышение температуры ведет к разрыву цепей, и жидкость снова становится подвижной, вязкость
расплава уменьшается. При 300°С сера переходит в текучее состояние, а при 444,6°С закипает. В зависимости от температуры в ее парах обнаруживают молекулы S 8 , S 6 , S 4 , S 2 . При 1760°С пары серы одноатомны. Таким образом, с увеличением температуры число атомов в молекуле постепенно уменьшается:
S 8 " S 6 " S 4 " S 2 " S
Изменение состава молекул вызывает изменение окраски паров серы от оранжево-желтого до соломенно-желтого.
Сера в обычных условиях имеют различный цвет (см. выше). Окраска этих веществ обусловлена способностью поглощать какую-то часть спектра белого света. В результате этого они окрашены в какой-нибудь дополнительный (к цвету поглощения лучей) цвет. Дополнительными, или взаимокомпенсирующими, до белого цвета являются следующие пары цветовых сочетаний: красный - голубой, желтый - синий, зеленый - пурпурный и т. д. «Вычитание» какого-либо цвета из белого дает дополнительную окраску вещества. Так, ромбическая сера поглощает синий цвет, поэтому она окрашена в желтый, кристаллический моноклинный селен красного цвета, так как поглощает голубой.
Сера совершенно не проводит тока и при трении заряжается отрицательным электричеством, поэтому из нее делают круги электрических машин, в которых электрический заряд возбуждается посредством трения. Очень плохо проводит сера и тепло. Если в ней содержится менее 0,1% примесей, то при согревании куска серы в руке слышится своеобразный треск, и случается, что кусок распадается на части. Это происходит из-за напряжений, возникающих в куске вследствие его неравномерного расширения в связи с малой теплопроводностью серы.
Химические свойства.
Сера в обычных условиях с водородом не соединяется. Лишь при нагревании происходит обратимая реакция:
Н 2 + S D H 2 S + 20,92 кдж / моль
Равновесие ее при 350°С смещено вправо, а при более высокой температуре - влево.
Все элементы VI группы взаимодействуют с галогенами. Известны галогениды серы, селена и теллура и других элементов группы. Например, хлорид или бромид серы получают при нагревании серы с галогенами в запаянной трубке:
2S + Br 2 = 83 Br 2
2S+Cl 2 = S 2 Cl 2
Хлорид серы S 2 Cl 2 является хорошим растворителем многих химических соединений серы. В частности, в химической промышленности его используют в качестве растворителя серы при вулканизации каучука.
Сера с водой и разбавленными кислотами не взаимодействуют, в то время как теллур окисляется водой при температуре 100-160°С:
Те + 2Н 2 О==ТеO 2 + 2Н 2 #
Со щелочами сера взаимодействуют с образованием сульфидов и сульфитов (реакция обратимая):
3S + 6КОН D 2К 2 S + К 2 SО 4 + ЗH 2 O
Сера, так же как и кислород, взаимодействует со всеми металлами, кроме золота, платины, иридия, с образованием сульфидов. Эти реакции идут обычно при нагревании, но с некоторыми металлами и без нагревания. Так, со ртутью сера вступает в реакцию в обычных условиях при простом соприкосновении веществ. Если в лаборатории разлили ртуть (возникла опасность отравления парами ртути), ее сначала собирают, а те участки, где ртутные капли нельзя извлечь, засыпают порошкообразной серой. Происходит реакция с образованием безвредного сульфида ртути (II), или киновари:
В школьных условиях можно легко получить сульфиды некоторых металлов, например CuzS. Для этого в пробирку, закрепленную в штативе, вносят немного серы и нагревают ее до кипения. Затем щипцами вводят в пары серы предварительно подогретую полоску медной фольги. Медь энергично взаимодействует с серой: 2 Сu +S = Cu 2 S
ДОБЫЧА СЕРНЫХ РУД И ПОЛУЧЕНИЕ СЕРЫ
В древности и в средние века серу добывали примитивным способом. В землю вкапывали большой глиняный горшок, на который ставили другой, но с отверстием в дне. Последний заполняли породой, содержа
щей серу, и затем нагревали. Сера плавилась и стекала в нижний горшок.
В настоящее время руды добывают разными способами, в зависимости от условий их залегания. Но в любом случае большое внимание уделяется технике безопасности. Ведь часто залежам серных руд сопутствуют скопления ядовитого газа - сероводорода. Да и сама сера может самовозгораться. При открытом способе добычи серы шагающий экскаватор снимает пласты пород, под которыми залегает руда. Рудные пласты дробят взрывами и далее глыбы руды отправляют на
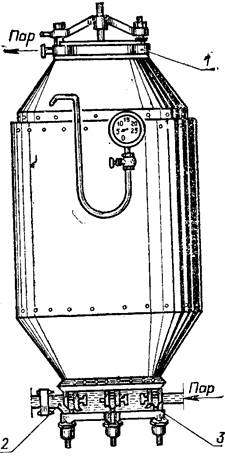
сероплавильиый завод, где из них извлекают серу. Если сера залегает глубоко и в значительном количестве, то ее получают по методу Фраша. В этом случае серу расплавляют под землей и через скважину, подобно нефти, выкачивают на поверхность, т. е. этот способ основан на легкоплавкости серы и ее сравнительно небольшой плотности.
Установка Фраша доволь проста: труба в трубе. В пространство между трубами подается перегретая вода и по нему идет в пласт, а по внутренней трубе, обогреваемой со всех сторон, поднимается
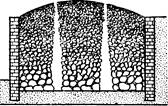
Термические методы извлечения серы из руд наиболее старые. Еще в XVIII в. в Неаполитанском королевстве серу выплавляли в кучах-«сольфаторах». До сих пор в Итални выплавляют серу в примитивных печах-калькаронах. Калькарона-одна из самых старых сероплавильных печей. Это открытая сверху камера цилиндрической формы. Обычно калькароны располагали на уступах скал или углубляли в землю. Куски руды в такие печи укладывали определенным образом:
внизу-большие, сверху-маленькие. При этом обязательно оставляли вертикальные ходы для тяги. Этот процесс малоэффективен: 45% потерь, так как часть серы сжигают для получения теплоты, необходимой при выплавке серы из руды.
Италия стала родиной и второго метода извлечения серы из руд-пароводяного, предшественника автоклавного. В этом процессе серная руда, содержащая до 80% серы, поступает в автоклав. Туда же под давлением подают водяной пар. Пульпу нагревают до 130°С. Сера, содержащаяся в концентрате, плавится и отделяется от породы. После недолгого отстоя серу сливают и только потом из автоклава выпускают взвесь пустой породы в воде - «хвосты». Последние содержат довольно много серы и вновь поступают на обогатительную фабрику. Современные автоклавы-это огромные аппараты высотой с четырехэтажный дом. Такие автоклавы установлены у нас в Прикарпатье, в частности на сероплавильном заводе Раздольского горнохимического комбината.
Иногда пустую породу отделяют от расплавленной серы на специальных фильтрах. В нашей стране используют метод разделения на центрифугах.
Однако сера, полученная выплавкой из руды (комовая сера), обычно содержит еще много примесей. Дальнейшую очистку ее производят перегонкой в рафинированных печах, где сера нагревается до кипения. Пары серы поступают в выложенную кирпичом камеру. Вначале, пока камера холодная, сера переходит в твердое состояние и осаждается на стенках в виде светло-желтого порошка (серный цвет). Когда камера нагреется выше 120°С, пары конденсируются в жидкость, которую выпускают из камеры в формы, где она и застывает в виде палочек. Полученная таким образом сера называется черенковой.
Способы получения серы в разных странах неодинаковы. Так, в США и Мексике применяют в основном метод Фраша. В Италии (она занимает третье место по добыче серы среди капиталистических государств) используют разные методы переработки серных сицилийских руд и руд из Марокко. Япония имеет значительные запасы серы вулканического происхождения. Франция и Канада, не имеющие самородной серы, развили ее крупное производство из газов. В Англии и ФРГ перерабатывают сырье, содержащее серу (FeS 2), а элементарную серу покупают, так как в этих странах нет собственных серных месторождений.
|
СССР и социалистические страны благодаря собственным источникам сырья применяют разнообразные методы добычи серы. За последние годы возросла производство серы из природных и отходящих газов цветной металлургии.
Обычно в сере, которую получают из руд, остается после ее очистки 0,6% примесей, а в сере, полученной из газов,- только 0,2%. При этом газовая сера значительно дешевле.
В настояще время в Узбекистане пущена первая очередь Мубарекского газоперерабатываюшего завода- одного из крупнейших предприятий отечественной газовой химической промышленности. Около поселка Мубарек Кашкадарьинской области было обнаружено мощное месторождение природного газа, содержащего 6% сероводорода. Серу стали получать из сероводорода при нагревании его в присутствии катализаторов. Ежедневно новое предприятие будет перерабатывать 4,7 млрд. м 3 природного газа и выпускать 220 тыс. т чистой серы. Получая серу этим способом, попутно очищают большие количества природного газа от примесей.
ПРИМЕНЕНИЕ СЕРЫ
Основным потребителем серы является химическая промышленность. Примерно половина добываемой в мире серы идет на производство серной кислоты, роль которой в химической промышленности велика. Чтобы получить 1 т серной кислоты, нужно сжечь 300 кг серы.
Большое количество серы расходуется на производство черного пороха, сероуглерода, различных красителей, светящихся составов и бенгальских огней.
|
Значительную часть мировой добычи серы поглощает бумажная промышленность. Для того чтобы произвести 1 7 целлюлозы, нужно затратить более 100 кг серы.
В резиновой промышленности сера применяется для превращения каучука в резину. Свои ценные свойства (упругость, эластичность и др.) каучук приобретает после смешивания его с серой и нагревания до определенной температуры. Такой процесс носит название вулканизации. Последняя может быть горячей и холодной. В первом случае
каучук нагревают с серой до 130-160°С. Этот способ был предложен в 1839 г. Ч. Гудиром. Во втором случае процесс ведут без нагревания, обрабатывая каучук хлоридом серы S2C12. Холодная вулканизация была предложена в 1J846 г. А. Парксом. Сущность вулканизации заключается в образовании новых связей между полимерными группами. При этом мостики могут содержать 1, 2, 3 и т. д. атомов серы:
В сельском хозяйстве сера применяется как в элементарном виде, так и в виде соединений. Установлено, что потребность растений в этом элементе немногим меньше фосфора. Серные удобрения влияют не только на количество, но и качество урожая. Опытами доказано, что серные удобрения влияют на морозостойкость злаков. Они способствуют образованию органических веществ, содержащих сульфогидрильные группы-S-Н. Это приводит к изменению внутренней структуры белков, их гидрофильности, что повышает морозостойкость растений в целом. Применяют серу в сельском хозяйстве и для борьбы с болезнями растений, главным образом винограда и хлопчатника.
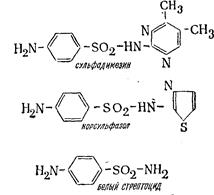
В медицине используется как элементарная сера, так и ее соединения. Например, мелкодисперсная сера-основа мазей, необходимых для лечения различных грибковых заболеваний кожи. Все сульфамидные препараты, (сульфидин, сульфазол, норсульфазол, сульфодимезин, стрептоцид и др.) -это органические соединения серы, например:
Растет количество серы, добываемой из недр земли, из промышленных газов, при очистке топлива. В мире сейчас уже производится на 10% серы больше, чем используется. Ей ищут новые области применения, предполагают использовать в строительной индустрии. В Канаде уже изготовлен серный пенопласт, который будет применен в строительстве шоссейных дорог и при прокладке трубопроводов в условиях вечной мерзлоты. В Монреале построен одноэтажный дом, состоящий из необычных блоков: 70% песка и 30% серы. Приготовляются блоки в металлических формах при температуре спекания 120°С. По прочности и стойкости они не уступают цементным. Защита их от окисления достигается покраской любым синтетическим лаком. Можно сооружать гаражи, магазины, склады и дачи. Появились сведения и о других строительных материалах, содержащих серу. Оказалось, что с помощью серы можно получать отличные асфальтовые покрытия, способные при сооружении автострад заменять трехкратное количество гравия. Такова, к примеру, смесь 13,5% серы, 6% асфальта и 80,5% песка.
ОПРЕДЕЛЕНИЕ
Сера расположена в третьем периоде VI группе главной (А) подгруппе Периодической таблицы.
Относится к элементам p-семейства. Неметалл. Элементы-неметаллы, входящие в эту группу, носят общее название халькогены. Обозначение - S. Порядковый номер - 16. Относительная атомная масса — 32,064 а.е.м.
Электронное строение атома серы
Атом серы состоит из положительно заряженного ядра (+16), состоящего из 16 протонов и 16 нейтронов, вокруг которого по 3-м орбитам движутся 16 электронов.
Рис.1. Схематическое строение атома серы.
Распределение электронов по орбиталям выглядит следующим образом:
1s 2 2s 2 2p 6 3s 2 3p 4 .
На внешнем энергетическом уровне атома серы находится шесть электронов, все они считаются валентными. Энергетическая диаграмма принимает следующий вид:
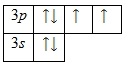
Наличие двух неспаренных электронов свидетельствует о том, что сера способна проявлять степень окисления +2. Также возможно несколько возбужденных состояний из-за наличия вакантной 3d -орбитали. Сначала распариваются электроны 3p -подуровня и занимают свободные d -орбитали, а после - электроны 3s -подуровня:
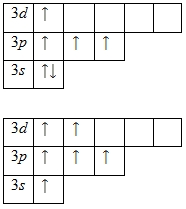
Этим объясняется наличие у серы ещё двух степеней окисления: +4 и +6.
Примеры решения задач
ПРИМЕР 1
Сера
СЕ́РА -ы; ж.
1. Химический элемент (S); легко воспламеняющееся вещество жёлтого цвета (применяется в промышленности, военном деле, сельском хозяйстве, медицине).
2. Жёлтое жирное вещество, образующееся на стенках ушного канала. Прочистить от серы уши.
◁ Се́рный (см.).
се́ра(лат. Sulfur), химический элемент VI группы периодической системы. Жёлтые кристаллы. Устойчива в двух модификациях - ромбической (плотность 2,07 г/см 3 , t пл 112,8°C) и моноклинной (плотность 1,96 г/см 3 , t пл 119°C). В воде нерастворима. На воздухе устойчива; при горении даёт SO 2 , с металлами образует сульфиды. В природе - самородная сера, сульфиды, сульфаты. Серу выплавляют из самородных руд; получают также окислением кислородом воздуха сероводорода, содержащегося в природном, нефтяном, коксовом газах, и другими методами. Около 50% серы идёт на получение серной кислоты, 25% - на получение сульфитов (используются в бумажной промышленности), остальная - для борьбы с болезнями растений, вулканизации, синтеза красителей, производства спичек и др.
СЕРАСЕ́РА (лат. Sulfur), S, химический элемент с атомным номером 16, атомная масса 32,066. Химический символ серы S произносится «эс». Природная сера состоит из четырех стабильных нуклидов (см.
НУКЛИД)
: 32 S (содержание 95,084% по массе), 33 S (0,74 %), 34 S (4,16%) и 36 S (0,016 %). Радиус атома серы 0,104 нм. Радиусы ионов: иона S 2– 0,170 нм (координационное число 6), иона S 4+ 0,051 нм (координационное число 6) и иона S 6+ 0,026 нм (координационное число 4). Энергии последовательной ионизации нейтрального атома серы от S 0 до S 6+ равны, соответственно, 10,36, 23,35, 34,8, 47,3, 72,5 и 88,0 эВ. Сера расположена в VIA группе периодической системы Д. И. Менделеева, в 3-м периоде, и принадлежит к числу халькогенов. Конфигурация внешнего электронного слоя 3s
2
3p
4
. Наиболее характерны степени окисления в соединениях –2, +4, +6 (валентности соответственно II, IV и VI). Значение электроотрицательности серы по Полингу 2,6. Сера относится к числу неметаллов.
В свободном виде сера представляет собой желтые хрупкие кристаллы или желтый порошок.
Историческая справка
Сера встречается в природе в свободном (самородном) состоянии, поэтому она была известна человеку уже в глубокой древности. Сера привлекала внимание характерной окраской, голубым цветом пламени и специфическим запахом, возникающим при горении (запах сернистого газа). Считалось, что горящая сера отгоняет нечистую силу. В Библии говорится об использовании серы для очищения грешников. У человека средневековья запах «серы» ассоциировался с преисподней. Применение горящей серы для дезинфекции упоминается Гомером. В Древнем Риме с помощью сернистого газа отбеливали ткани.
Издавна использовалась сера в медицине - ее пламенем окуривали больных, ее включали в состав различных мазей для лечения кожных заболеваний. В 11 в. Авиценна (Ибн Сина (см.
ИБН СИНА)
), а затем и европейские алхимики полагали, что металлы, в том числе золото и серебро, состоят из находящихся в различных соотношениях серы и ртути. Поэтому сера играла важную роль в попытках алхимиков найти «философский камень» и превратить недрагоценные металлы в драгоценные. В 16 в. Парацельс (см.
ПАРАЦЕЛЬС)
считал серу наряду с ртутью и «солью» одним из основных «начал» природы, «душою» всех тел.
Практическое значение серы резко возросло после того, как изобрели черный порох (в состав которого обязательно входит сера). Византийцы в 673 г., защищая Константинополь, сожгли флот неприятеля с помощью так называемого греческого огня - смеси селитры, серы, смолы и других веществ - пламя которого не гасилось водой. В средние века в Европе применялся черный порох, по составу близкий к смеси греческого огня. С тех пор началось широкое использование серы для военных целей.
Издавна было известно и важнейшее соединение серы - серная кислота. Один из создателей ятрохимии (см.
ЯТРОХИМИЯ)
, монах Василий Валентин, в 15 в. подробно описал получение серной кислоты путем прокаливания железного купороса (старинное название серной кислоты - купоросное масло).
Элементарную природу серы установил в 1789 А. Лавуазье (см.
ЛАВУАЗЬЕ Антуан Лоран)
. В названиях химических соединений, содержащих серу, часто содержится приставка «тио» (например, применяемый в фотографии реактив Na 2 S 2 O 3 имеет название тиосульфат натрия). Происхождение этой приставки связано с греческим названием серы - theion.
Нахождение в природе
Сера довольно широко распространена в природе. В земной коре ее содержание оценивается в 0,05% по массе. В природе часто встречаются значительные залежи самородной серы (обычно вблизи вулканов); в Европе они расположены на юге Италии, в Сицилии. Большие залежи самородной серы имеются в США (в штатах Луизиана и Техас), а также в Средней Азии, в Японии, в Мексике. В природе сера встречается как россыпями, так и в виде кристаллических пластов, иногда образуя изумительные по красоте группы полупрозрачных желтых кристаллов (так называемые друзы).
В вулканических местностях часто наблюдается выделение из-под земли газа сероводорода H 2 S; в этих же регионах сероводород встречается в растворенном виде в серных водах. Вулканические газы часто содержат также сернистый газ SO 2 .
На поверхности нашей планеты широко распространены месторождения различных сульфидных соединений. Наиболее часто среди них встречаются: железный колчедан (пирит (см.
ПИРИТ)
) FeS 2 , медный колчедан (халькопирит) CuFeS 2 , свинцовый блеск (см.
ГАЛЕНИТ)
PbS, киноварь (см.
КИНОВАРЬ)
HgS, сфалерит (см.
СФАЛЕРИТ)
ZnS и его кристалическая модификация вюртцит (см.
ВЮРТЦИТ)
, антимонит (см.
АНТИМОНИТ)
Sb 2 S 3 и другие. Известны также многочисленные месторождения различных сульфатов, например, сульфата кальция (гипс CaSO 4 ·2H 2 O и ангидрит CaSO 4), сульфата магния MgSO 4 (горькая соль), сульфата бария BaSO 4 (барит), сульфата стронция SrSO 4 (целестин), сульфата натрия Na 2 SO 4 ·10H 2 O (мирабилит) и др.
Каменные угли содержат в среднем 1,0-1,5% серы. Сера может входить и в состав нефти. Целый ряд месторождений природного горючего газа (например, Астраханское) содержат как примесь сероводород.
Сера относится к элементам, которые необходимы для живых организмов, так как она является существенной составной частью белков. Белки содержат 0,8-2,4% (по массе) химически связанной серы. Растения получают серу из сульфатов, содержащихся в почве. Неприятные запахи, возникающие при гниении трупов животных, объясняются главным образом выделением соединений серы (сероводорода и меркаптанов (см.
ТИОЛЫ)
), образующихся при разложении белков. В морской воде присутствует около 8,7·10 -2 % серы.
Получение
Серу получают, в основном, выплавляя ее из горных пород, содержащих самородную (элементарную) серу. Так называемый геотехнологический способ позволяет получать серу без подъема руды на поверхность. Этот способ был предложен в конце 19 в. американским химиком Г. Фрашем, перед которым встала задача извлечения на поверхность земли серы из месторождений юга США, где песчаный грунт резко усложнял ее добычу традиционным шахтным методом.
Фраш предложил использовать для подъема серы на поверхность перегретый водяной пар. Перегретый пар по трубе подают в подземный слой, содержащий серу. Сера плавится (ее температура плавления немного ниже 120°С) и по трубе, расположенной внутри той, по которой под землю закачивают водяной пар, поднимается наверх. Для того, чтобы обеспечить подъем жидкой серы, через самую тонкую внутреннюю трубу нагнетают сжатый воздух.
По другому (термическому) методу, получившему особое распространение в начале 20 в. на Сицилии, серу выплавляют, или возгоняют, из дробленной горной породы в специальных глиняных печах.
Существуют и другие методы выделения самородной серы из породы, например, экстракцией сероуглеродом или флотационными методами.
В связи с тем, что потребность промышленности в сере очень велика, разработаны методы ее получения из сероводорода H 2 S и сульфатов.
Метод окисления сероводорода до элементарной серы был впервые разработан в Великобритании, где значительные количества серы научились получать из остающегося после получении соды Na 2 CO 3 по методу французского химика Н. Леблана (см.
ЛЕБЛАН Никола)
сульфида кальция CaS. Метод Леблана основан на восстановлении сульфата натрия углем в присутствии известняка CaCO 3 .
Na 2 SO 4 + 2C = Na 2 S + 2CO 2 ;
Na 2 S + CaCO 3 = Na 2 CO 3 + CaS.
Соду затем выщелачивают водой, а водную суспензию плохо растворимого сульфида кальция обрабатывают диоксидом углерода:
CaS + CO 2 + H 2 O = CaCO 3 + H 2 S
Образующийся сероводород H 2 S в смеси с воздухом пропускают в печи над слоем катализатора. При этом за счет неполного окисления сероводорода образуется сера:
2H 2 S + O 2 = 2H 2 O +2S
Аналогичный метод используют для получения элементарной серы и из сероводорода, сопутствующего природным газам.
Так как современная техника нуждается в сере высокой чистоты, разработаны эффективные методы рафинирования серы. При этом используют, в частности, различия в химическом поведении серы и примесей. Так, мышьяк и селен удаляют, обработав серу смесью азотной и серной кислот.
Использованием методов, основанных на дистилляции и ректификации, удается получить высокочистую серу с содержанием примесей 10 –5 –10 –6 % по массе.
Физические и химические свойства
Атомы серы обладают уникальной способностью образовывать устойчивые гомоцепи, т. е. цепи, состоящие только из атомов S (энергия связи S–S составляет около 260 кДж/моль). Гомоцепи серы имеют зигзагообразную форму, так как в их образовании принимают участие электроны, расположенные в соседних атомах на взаимно перпендикулярных р-орбиталях. Эти цепи могут достигать большой длины, или, наоборот, образовывать замкнутые кольца S 20 , S 8 , S 6 , S 4 .
Поэтому сера образует несколько десятков как кристаллических, так и аморфных модификаций, отличающихся как составом молекул и полимерных цепей, так и способом их упаковки в твердом состоянии.
При нормальном давлении и температурах до 98,38 °C стабильна a-модификация серы (иначе эту модификацию называют ромбической), образующая лимонно-желтые кристаллы. Ее кристаллическая решетка орторомбическая, параметры элементарной ячейки a = 1,04646, b = 1,28660, c = 2,4486 нм. Плотность 2,07 кг/дм 3 . Выше 95,39 °C стабильна b -модификация серы (так называемая моноклинная сера). При комнатной температуре параметры элементарной ячейки моноклинной b-S a = 1.090, b = 1.096, c = 1,102 нм, t = 83,27 °С. Плотность b-S 1,96 кг/дм 3 .
В структурах как a-, так и b-модификаций серы имеются неплоские восьмичленные циклические молекулы S 8 . Такие молекулы немного похожи на короны.
Две эти модификации серы отличаются взаимной ориентацией молекул S 8 в кристаллической решетке.
Еще одну модификацию серы - так называемую ромбоэдрическую серу - можно получить выливанием раствора тиосульфата натрия Na 2 S 2 O 3 в концентрированную соляную кислоту при 0 °C с последующей экстракцией серы толуолом (см.
ТОЛУОЛ)
. После испарения растворителя возникают ромбоэдрические кристаллы, содержащие молекулы S 6 в форме кресла.
Аморфную серу (плотность 1,92 г/см 3) и резиноподобную пластическую серу получают при резком охлаждении расплавленной серы (выливая расплав в холодную воду). Эти модификации состоят из нерегулярных зигзагообразных цепей S n . При длительном выдерживании при температурах 20-95 °C все модификации серы превращаются в a-серу.
Температура плавления ромбической a -серы 112,8 °С, а моноклинной b-серы 119,3 °С. И в том, и в другом случае образуется легкоподвижная желтая жидкость, которая при температуре около 160 °С темнеет; ее вязкость повышается, и при температуре выше 200 °С расплавленная сера становится темно-коричневой и вязкой, как смола. Это объясняется тем, что сначала в расплаве разрушаются кольцевые молекулы S 8 . Возникающие фрагменты объединяются друг с другом с образованием длинных цепей S µ из нескольких сотен тысяч атомов. Дальнейшее нагревание расплавленной серы (выше температуры 250 °C) ведет к частичному разрыву цепей, и жидкость снова становится более подвижной. На рис. показана температурная зависимость вязкости жидкой серы. Около 190 °C ее вязкость примерно в 9000 раз больше, чем при 160 °C.
При температуре 444,6 °C расплавленная сера закипает. В зависимости от температуры в ее парах можно обнаружить молекулы S 8 , S 6 , S 4 и S 2 . Изменение состава молекул вызывает изменение окраски паров серы от оранжево-желтого до соломенно-желтого цвета. При температуре выше 1500 °C молекулы S 2 диссоциируют на атомы.
Молекулы S 2 парамагнитны (см.
ПАРАМАГНЕТИК)
и построены аналогично молекуле O 2 . Во всех других состояниях сера диамагнитна (см.
ДИАМАГНЕТИК)
.
В воде сера практически нерастворима. Некоторые ее модификации растворяются в органических жидкостях (толуоле, бензоле) и особенно хорошо - в сероуглероде CS 2 и жидком аммиаке NH 3 .
Сера - достаточно активный неметалл. Даже при умеренном нагревании она окисляет многие простые вещества, но и сама довольно легко окисляется кислородом и галогенами.
S + O 2 = SO 2 , S + 3F 2 = SF 6 ,
2S + Cl 2 = S 2 Cl 2 (c примесью SCl 2)
С водородом при нагревании сера образует сероводород H 2 S и в небольшом количестве сульфаны (соединения состава H 2 S n):
H 2 + S H 2 S.
Примеры реакций серы с металлами:
2Na + S = Na 2 S, Ca + S = CaS, Fe + S = FeS
Образующиеся в этих реакциях сульфиды характеризуются не постоянным, а, как правило, переменным составом. Так, состав сульфида кальция может непрерывно изменяться в границах от CaS до CaS 5 . Полисульфиды типа СаS n или Na 2 S n при взаимодействии, например, с соляной кислотой образуют сульфаны H 2 S n
, причем значение n может составлять от 1 до приблизительно 10.
Концентрированная серная кислота при нагревании окисляет серу до SO 2:
S + 2H 2 SO 4 = 2H 2 O + 3SO 2 .
Царская водка (смесь азотной и соляной кислот) окисляет серу до серной кислоты.
Разбавленная азотная кислота, соляная кислота без окислителей и серная кислота на холоде с серой во взаимодействие не вступают. При нагревании в кипящей воде или растворах щелочей сера диспропорционирует:
3S + 6NaOH 2Na 2 S + Na 2 SO 3 + 3H 2 O;
Сера может присоединяться к сульфидам
Na 2 S + (n–1)S = Na 2 S n
и к сульфитам:
Na 2 SO 3 + S = Na 2 S 2 O 3
В результате протекания данной реакции из сульфита натрия Na 2 SO 3 образуется тиосульфат натрия Na 2 S 2 O 3 .
При нагревании сера реагирует почти со всеми элементами, кроме инертных газов, иода, азота, платины и золота.
Известно несколько оксидов серы. Кроме устойчивых диоксида серы SO 2 [другие названия: сернистый газ, сернистый ангидрид, оксид серы (IV)] и триоксида серы SO 3 [другие названия: серный газ, серный ангидрид, оксид серы (VI)], получены неустойчивые оксиды S 2 O (при пропускании тока SO 2 через тлеющий разряд) и S 8 O (при взаимодействии H 2 S c SOCl 2). Пероксиды SO 4 и S 2 O 7 образуются при пропускании SO 2 в смеси с кислородом через тлеющий разряд или за счет окисления SO 2 озоном.
Кислотному диоксиду серы SO 2 соответствует неустойчивая кислота средней силы H 2 SO 3 (сернистая кислота):
Н 2 О + SO 2 H 2 SO 3 ,
а кислотному триоксиду серы SO 3 - сильная двухосновная серная кислота (см.
СЕРНАЯ КИСЛОТА)
H 2 SO 4:
SO 3 + H 2 O = H 2 SO 4
И сернистой кислоте H 2 SO 3 , и серной H 2 SO 4 соответствуют по два ряда солей: кислые [соответственно гидросульфиты NaHSO 3 , Ca(HSO 3) 2 и др. и гидросульфаты КНSO 4 , NaНSO 4 и другие] и средние [сульфиты Na 2 SO 3 , K 2 SO 3 и сульфаты CaSO 4 , Fe 2 (SO 4) 3 ].
Сера входит в состав многих органических соединений (см. статьи Тиофен (см.
ТИОФЕН)
, Тиолы (см.
ТИОЛЫ)
и другие).
Применение
Около половины производимой серы используется на производство серной кислоты, около 25% расходуется для получения сульфитов, 10-15% - для борьбы с вредителями сельскохозяйственных культур (главным образом винограда и хлопчатника) (наибольшее значение здесь имеет раствор медного купороса CuSO 4 ·5H 2 O), около 10% используется резиновой промышленностью для вулканизации резины. Серу применяют при производстве красителей и пигментов, взрывчатых веществ (она до сих пор входит в состав пороха), искусственных волокон, люминофоров (см.
ЛЮМИНОФОРЫ)
. Серу используют при производстве спичек, так как она входит в состав, из которого изготовляют головки спичек. Серу до сих пор содержат некоторые мази, которыми лечат заболевания кожи. Для придания сталям особых свойств в них вводят небольшие добавки серы (хотя, как правило, примесь серы в сталях нежелательна).
Биологическая роль
Сера постоянно присутствует во всех живых организмах, являясь важным биогенным элементом (см.
БИОГЕННЫЕ ЭЛЕМЕНТЫ)
. Ее содержание в растениях составляет 0,3-1,2 %, в животных 0,5-2 % (морские организмы содержат больше серы, чем наземные). Биологическое значение серы определяется прежде всего тем, что она входит в состав аминокислот метионина (см.
МЕТИОНИН)
и цистеина (см.
ЦИСТЕИН)
и, следовательно, в состав пептидов (см.
ПЕПТИДЫ)
и белков. Дисульфидные связи –S–S– в полипетидных цепях участвуют в формировании пространственной структуры белков, а сульфгидрильные группы (–SH) играют важную роль в активных центрах ферментов. Кроме того, сера входит в молекулы гормонов, важных веществ. Много серы содержится в кератине волос, костях, нервной ткани. Неорганические соединения серы необходимы для минерального питания растений. Они служат субстратами окислительных реакций, осуществляемых распространенными в природе серобактериями (см.
СЕРОБАКТЕРИИ)
.
В организме среднего человека (масса тела 70 кг) содержится около 1402 г серы. Суточная потребность взрослого человека в сере - около 4.
Однако по своему отрицательному воздействию на окружающую среду и человека сера (точнее, ее соединения) стоит на одном из первых мест. Основной источник загрязнения серой - сжигание каменного угля и других видов топлива, содержащих серу. При этом около 96% серы, содержащейся в топливе, попадает в атмосферу в виде сернистого газа SO 2 .
В атмосфере сернистый газ постепенно окисляется до оксида серы (VI). Оба оксида - и оксид серы (IV), и оксид серы (VI) - взаимодействуют с парами воды с образованием кислотного раствора. Затем эти растворы выпадают в виде кислотных дождей. Оказавшись в почве, кислотные воды угнетают развитие почвенной фауны и растений. В результате создаются неблагоприятные условия для развития растительности, особенно в северных регионах, где к суровому климату добавляется химическое загрязнение. В результате гибнут леса, нарушается травяной покров, ухудшается состояние водоемов. Кислотные дожди разрушают изготовленные из мрамора и других материалов памятники, более того, они вызывают разрушение даже каменных зданий и изделий из металлов. Поэтому приходится принимать разнообразные меры по предотвращению попадания соединений серы из топлива в атмосферу. Для этого подвергают очистке от соединений серы нефть и нефтепродукты, очищают образующиеся при сжигании топлива газы.
Сама по себе сера в виде пыли раздражает слизистые оболочки, органы дыхания и может вызывать серьезные заболевания. ПДК серы в воздухе 0,07 мг/м 3 .
Толковый словарь Даля
СЕРА - СЕРА, Sulfur, хим. элемент VІ гр. Менделеевской системы, символ S, порядковый номер 16, ат. в. 32,07. Известна с древнейших времен. В природе встречается в виде залежей водного (нептунического) и вулканического. происхождения. Встречается также в … Большая медицинская энциклопедия
СЕРА - хим. элемент, символ S (лат. Sulfur), ат. н. 16, ат. м. 32,06. Существует в виде нескольких аллотропных модификаций; среди них сера моноклинной модификации (плотность 1960 кг/м3, tпл = 119°С) и ромбическая сера (плотность 2070 кг/м3, ίπι = 112,8… … Большая политехническая энциклопедия
- (обозначается S), химический элемент VI группы ПЕРИОДИЧЕСКОЙ ТАБЛИЦЫ, неметалл, известный с древности. Встречается в природе как в виде отдельного элемента, так и в виде сульфидных минералов, таких как ГАЛЕНИТ и ПИРИТ, и сульфатных минералов,… … Научно-технический энциклопедический словарь
В мифологии ирландских кельтов Сера отец Парталона (см. глава 6). Согласно некоторым источникам, именно Сера, а не Парталон был мужем Дилгнейд. (
Сера - минерал лимонно-желтого цвета, иногда медово-жёлтого, желтовато-серого или коричневатого, представляет собой молекулярную серу – S, минерал очень хрупкий, твердость 1-2.
Бурый или чёрный цвет кристаллам могут придавать включения органики, капелек нефти.
Кристаллизуется в ромбической сингонии. Встречается в виде кристаллов пирамидальной формы и в зернистых агрегатах. Иногда наблюдаются натёчные почковидные формы и налёты, землистые массы.
Блеск алмазный, на изломе жирный, в кристаллах просвечивает. Самородная сера чувствительна к повышенным температурам, растрескивается даже от теплоты рук. От спички она легко плавится и загорается голубым пламенем.
Название
Происхождение латинского слова sulfur неизвестно. Русское название элемента обычно производят от санскритского «сира» - светло-желтый. Возможно родство «серы» с древнееврейским «серафим» - мн. числом от «сераф» - буквально «сгорающий», а сера хорошо горит. В древнерусском и старославянском «сера» - вообще любое горючее вещество, в том числе и жир.
Происхождение
Сера образуется исключительно на поверхности земной коры, в результате вулканических извержений, осаждаясь в виде возгонов, а иногда изливаясь в расплавленном виде. Образуется при выветривании сульфидов (главным образом пирита), или же накапливается в морских осадках, нефтях и битумах, биохимическим путём. Может ассоциировать с гипсом, выделяясь из его толщ. Большие скопления самородной серы в природе встречаются довольно редко. Чаще она присутствует во вмещающей породе в виде мелких вкраплений.
Месторождения
Залежи серы широко распространены на территории Средней Азии, месторождения Гаурдак, Шор-Су – в трещинах и пустотах различных осадочных пород в ассоциации с нефтью, гипсом,
целестином, кальцитом, арагонитом и др. В Кара-Кумской пустыне в виде бугров, прикрытых кремнистыми корками, в ассоциации с гипсом, кварцем, халцедоном, опалом и др. Большие осадочные месторождения
имеются в Поволжье (в районе города Куйбышева). Большой известностью пользуются месторождения Сицилии, мощные месторождения в штатах Техас и Луизиана (США), Боливии, Мишрак и Ираке, Южная Польша, Штасфурт в Германии. Области вулканизма: Камчатка, Япония, Италия, Индонезия.
Применение
Главное применение сера имеет в производстве серной кислоты, используемой во многих отраслях промышленности; используется в сельском хозяйстве для борьбы с вредителями, в резиновом производстве (процесс вулканизации каучука), при изготовлении спичек, красок, пиротехники.
Лечебные и магические свойства
Считается, что сера обладает свойством поглощать негативную энергию, помогает избегать конфликтов и ссор, усмиряет эмоциональные порывы.
Значительная часть природных лечебных методов базируется на использовании соединений серы, будь то долька чеснока или сероводородная ванна Мацесты. За оздоравливающий эффект здесь отвечают полисульфиды - соединения серы и сероводорода.
Сера издавна известна человеку. Сведения о ее использовании в Египте восходят ко второму тысячелетию до н. э. Знали серу и древние греки, и римляне. О ней упоминается в знаменитых произведениях Гомера, Плиния Старшего и в Библии. Серу с давних пор широко использовали в медицине. В лечебных целях издревле применяли ее и на Руси. Один из первых отечественных ученых, изучавших серу, М. В. Ломоносов писал: "Земля в своих недрах содержит такое количество серы, что не только ею заполнены подземелья... но это ископаемое выделяется даже на поверхности земли", отмечая в то же время, что встречается "она самородная и чистая, однакож редко". Несколько позже академик В. Севергин оценивал распространение серы уже более оптимистично: "Самородная сера чистая и в смешении с землями находится в России изобильно". Сейчас известно свыше 400 минералов, имеющих в своем составе серу. А ее содержание в земной коре составляет около 0,05%.
На наличие самородной серы в Крыму указывалось в середине прошлого века. О "розысках" здесь серы писал в 1849 г. "Горный журнал". Речь шла об окрестностях Чокракского озера на Керченском полуострове, где в известняке были обнаружены "весьма явственные, но весьма мелкие кристаллы самородной серы". Поручик Антипов провел здесь по распоряжению князя Воронцова разведочные работы с проходкой горных выработок. Оказалось, что сера приурочена только к выходам сероводородных источников. Ее образование было объяснено разложением сероводорода. "В заключение должен сказать, - пишет поручик, - что это месторождение серы не представляет какой-либо важности в техническом отношении, кроме одного целительного свойства источников, обещающих великую пользу". Тонкие белесые налеты серы можно наблюдать и в настоящее время у Чокракских и других источников сероводородных вод, например, в окрестностях Судака.
Самородная сера нередко образуется и при выветривании сульфидов - пирита и марказита. Ее находили в Крыму в связи с разнообразными горными породами: в мергелях у Феодосии, известняках окрестностей Бахчисарая, гранодиоритах вблизи Алушты. Сера этого типа входит обычно в состав землистых агрегатов в смеси с сульфатами и гидроксилами железа и представлена мельчайшими неправильными зернышками, иногда - кристалликами. Нередко ей сопутствует гипс. Тонкая порошковатая сера присутствует в илах соляных озер, например, Сакского.
Самые крупные скопления серы обнаружил в Крыму в 1883 г. Н. И. Андрусов на Керченском полуострове у деревни Чекур-Кояш. В дальнейшем оказалось, что здесь целое месторождение. Сера приурочена к гипсоносным глинам и мергелям и образует прослойки и желваки размерами от нескольких миллиметров до 30 см. Содержание ее в руде от 10 до 30%.
По одной из принятых гипотез самородная сера образовалась из гипса под действием обогащенных органическими веществами сероводородных вод при участии бактерий.
По нынешним масштабам месторождение выглядело бы скромным. Но в свое время оно сыграло важную роль. Дело в том, что до революции серу ввозили в Россию из-за границы. И Чекур-Кояшское месторождение одним из первых дало промышленную отечественную серу. Вот краткая история его освоения.
В прошлом веке кустарным способом было добыто лишь немного серы для местных нужд. Месторождение почти не изучалось. В 1906 г. его арендовала Бельгийская компания и начала геологическую разведку и подготовку к эксплуатации. Технический уровень работ был низким. Выработки плохо проветривались. Это привело к трагической гибели рабочего и администратора, отравившихся в забое серным газом, после чего работы были прекращены.
С начала первой мировой войны в стране сложилось критическое положение с серой, и по решению Военно-Промышленного Комитета в 1915 г. приступили к разведке Чекур-Кояша. В 1916 г. уже велась подготовка к отработке и попутная добыча. Было извлечено 1600 т. руды. Из нее вручную отобрали около 10 т. серы. Но в 1917 г. работы были прекращены и шахты залило водой.
Возрождение рудника началось со времени установления Советской власти в Крыму. Сначала небольшое количество серы получали на маленьком заводике из ранее добытой руды. Затем провели основательную геологическую разведку и подсчет запасов серы. В 1928 г. рудник и завод, практически построенные заново, начали давать серу. Добыча велась около 10 лет, и месторождение было выработано. Крымская сера в начальный период добычи играла важную роль. "Керченская сера имеет большое значение для Союза наших республик", - отмечалось в печати 30-х гг. С открытием и разработкой крупных месторождений Средней Азии сера Чекур-Кояша сохраняла лишь местное значение. В настоящее время на Керченском полуострове известно около десятка непромышленных проявлений серы.
Своеобразен внешний вид самородной серы. Цвет желтый разных оттенков, чаще соломенно-желтый. Блеск жирный. Сера образует пленки, землистые и порошковые массы, тонкие прослойки и желваки, реже встречается в правильных кристалликах. Характерны четырехгранные бипирамидки с усеченными вершинками самой распространенной ромбической, или так называемой альфа-серы. Она наиболее устойчива на поверхности земли. Любопытно, что в известняках района Керченского пролива С. П. Попов обнаружил в 1901 г., наряду с этой разновидностью, более редкие в природе пластинчатые кристаллы моноклинной (бета) серы. Это первая в мире находка бета-серы в условиях земной поверхности вне связи с вулканической деятельностью. Форма кристаллов бета-серы из Крыма но С. П. Попову прочно вошла в справочники по минералогии.
По твердости сера незначительно превосходит тальк - самый мягкий минерал шкалы Мооса. У талька твердость принята за 1, а у серы она составляет 1-2 по этой шкале. Сера в два раза тяжелее воды. Плотность ее около двух. Важным отличием является способность серы гореть. По Плинию Старшему, "никакое вещество столь удобно не возгорается, из чего явствует, что в ней заключена большая огненная сила". До появления современных представлений долгое время считали, что сера является носителем особого горючего вещества. Способность серы гореть можно использовать как надежный диагностический признак. Для проверки достаточно ничтожной крупинки вещества. Испытание можно провести на кончике лезвия перочинного ножа с помощью горящей спички пли спиртовки. Можно воспользоваться и раскаленной швейной иглой. Очень характерен и запах горящей серы, отличающий ее от других минералов. В тонких порошковатых и землистых выделениях сера бывает похожа на сульфаты железа. В отличие от многих сходных минералов сера растворяется в керосине и скипидаре.
Самородная сера нередко содержит до нескольких процентов примесей. В крымской сере установлены кальций, селен, мышьяк и некоторые другие элементы. Примеси могут ограничивать применение серы в отдельных отраслях промышленности.
Профессий у серы чрезвычайно много, причем издавна. "Польза ее весьма пространная, - писал в начале прошлого века В. Севергин. - Она употребляется различным образом в химии, во врачебном искусстве, на добывание серной кислоты, на приготовление киновари, огнестрельного пороха, в потешных огнях... на истребление насекомых". В настоящее время сера находит еще большее применение. Ежегодно в мире добывают десятки миллионов тонн самородной серы. Используют ее при производстве синтетических волокон, резины, красителей, в пищевой промышленности. Примерно половина добываемой серы идет на получение серной кислоты, четверть - в целлюлозно-бумажную промышленность, около 10% в сельское хозяйство. Крымскую серу применяли в основном для борьбы с вредителями виноградников и в санитарных целях.
Сера распространена в Крыму гораздо шире других минералов класса самородных элементов. Но найти хорошие ее образцы непросто. Приходится рассчитывать лишь на мельчайшие кристаллики в десятые доли миллиметра, различимые с помощью лупы, и на землистые и порошковатые налеты и выцветы в смеси с другими минералами. Но и такие образцы, особенно собственные находки, - отличный материал для коллекции
Происхождение серы
Большие скопления самородной серы встречаются не так уж часто. Чаще она присутствует в некоторых рудах. Руда самородной серы - это порода с вкраплениями чистой серы.
Когда образовались эти вкрапления - одновременно с сопутствующими породами или позже? От ответа на этот вопрос зависит направление поисковых и разведочных работ. Но, несмотря на тысячелетия общения с серой, человечество до сих пор не имеет однозначного ответа. Существует несколько теорий, авторы которых придерживаются противоположных взглядов.
Теория сингенеза (т. е. одновременного образования серы и вмещающих пород) предполагает, что образование самородной серы происходило в мелководных бассейнах. Особые бактерии восстанавливали сульфаты, растворенные в воде, до сероводорода, который поднимался вверх, попадал в окислительную зону и здесь химическим путем или при участии других бактерий окислялся до элементарной серы. Сера осаждалась на дно, и впоследствии содержащий серу ил образовал руду.
Теория эпигенеза (вкрапления серы образовались позднее, чем основные породы) имеет несколько вариантов. Самый распространенный из них предполагает, что подземные воды, проникая сквозь толщи пород, обогащаются сульфатами. Если такие воды соприкасаются с месторождениями нефти или природного газа, то ионы сульфатов восстанавливаются углеводородами до сероводорода. Сероводород поднимается к поверхности и, окисляясь, выделяет чистую серу в пустотах и трещинах пород.
В последние десятилетия находит все новые подтверждения одна из разновидностей теории эпигенеза - теория метасоматоза (в переводе с греческого «метасоматоз» означает замещение). Согласно ей в недрах постоянно происходит превращение гипса CaSO4-H2O и ангидрита CaSО4 в серу и кальцит СаСО3. Эта теория создана в 1935 году советскими учеными Л. М. Миропольским и Б. П. Кротовым. В ее пользу говорит, в частности, такой факт.
В 1961 году в Ираке было открыто месторождение Мишрак. Сера здесь заключена в карбонатных породах, которые образуют свод, поддерживаемый уходящими вглубь опорами (в геологии их называют крыльями). Крылья эти состоят в основном из ангидрита и гипса. Такая же картина наблюдалась на отечественном месторождении Шор-Су.
Геологическое своеобразие этих месторождений можно объяснить только с позиций теории метасоматоза: первичные гипсы и ангидриты превратились во вторичные карбонатные руды с вкраплениями самородной серы. Важно не только соседство минералов - среднее содержание серы в руде этих месторождений равно содержанию химически связанной серы в ангидрите. А исследования изотопного состава серы и углерода в руде этих месторождений дали сторонникам теории метасоматоза дополнительные аргументы.
Но есть одно «но»: химизм процесса превращения гипса в серу и кальцит пока не ясен, и потому нет оснований считать теорию метасоматоза единственно правильной. На земле и сейчас существуют озера (в частности, Серное озеро близ Серноводска), где происходит сингенетическое отложение серы и сероносный ил не содержит пи гипса, ни ангидрита.
Все это означает, что разнообразие теорий и гипотез о происхождении самородной серы - результат не только и не столько неполноты наших знаний, сколько сложности явлений, происходящих в недрах. Еще из элементарной школьной математики все мы знаем, что к одному результату могут привести разные пути. Этот закон распространяется и на геохимию.
Добыча серы
Добыча серы значительно увеличилась после того, как был изобретён чёрный порох. Ведь сера (вместе с углём и селитрой) – непременный его компонент. В наше время сера - один из важнейших видов сырья для многих химических производств. Ежегодное мировое потребление серы составляет около 20 млн. тонн. Её промышленными потребителями являются самые различные производства: сернокислотное, бумажное, резиновое, спичечное и др. Сера широко используется также для борьбы с вредителями сельского хозяйства, в пиротехнике, и отчасти в медицине. По содержанию в земной коре(0,03%) сера относится к весьма распространённым элементам. Однако большие скопления самородной серы встречаются не так уж часто. Чаще она присутствует некоторых рудах. Руда самородной серы - это порода с вкраплениями чистой серы. Когда образовались эти вкрапления - одновременно с сопутствующими породами или позже? От ответа на этот вопрос зависит направление поисковых и разведочных работ. Но, несмотря на тысячелетия общения с серой, человечество до сих пор не имеет однозначного ответа. Серные руды добывают разными способами - в зависимости от условий залегания. Но в любом случае приходится уделять много внимания технике безопасности. Залежам серы почти всегда сопутствуют скопления ядовитых газов-соединений серы. К тому же нельзя забывать о возможности её самовозгорания
Серные руды добывают разными способами-в зависимости от условий залегания. Но в любом случае приходится уделять много внимания технике безопасности. Залежам серы почти всегда сопутствуют скопления ядовитых газов - соединений серы. К тому же нельзя забывать о возможности ее самовозгорания.
Добыча руды открытым способом происходит так. Шагающие экскаваторы снимают пласты пород, под которыми залегает руда. Взрывами рудный пласт дробят, после чего глыбы руды отправляют на обогатительную фабрику, а оттуда-на сероплавильный завод, где из концентрата извлекают серу. Методы извлечения-различны. О некоторых из них будет рассказано ниже. А здесь уместно кратко описать скважинный метод добычи серы из-под земли, позволивший Соединенным Штатам Америки и Мексике стать крупнейшими поставщиками серы.
В конце прошлого века на юге Соединенных Штатов были открыты богатейшие месторождения серной руды. Но подступиться к пластам было непросто: в шахты (а именно шахтным способом предполагалось разрабатывать месторождение) просачивался сероводород и преграждал доступ к сере. Кроме того, пробиться к сероносным пластам мешали песчаные плывуны. Выход нашел химик Герман Фраш, предложивший плавить серу под" землей и через скважины, подобные нефтяным, выкачивать ее на поверхность. Сравнительно невысокая (меньше 120° С) температура плавления серы подтверждала реальность идеи Фраша. В 1890 году начались испытания, приведшие к успеху.
В принципе установка Фраша очень несложна: труба в трубе. В пространство между трубами подается перегретая вода и по нему идет в пласт. А по внутренней, обогреваемой со всех сторон, трубе поднимается расплавленная сера. Современный вариант установки Фраша дополнен третьей - самой узкой трубой. Через нее в скважину подается сжатый воздух, который помогает поднять расплавленную серу на поверхность. Одно из основных достоинств метода Фраша - в том, что он позволяет уже на первой стадии добычи получить сравнительно чистую серу. При разработке богатых руд этот метод весьма эффективен.
Раньше считалось, что метод подземной выплавки серы применим только в специфических условиях «соляных куполов» тихоокеанского побережья США и Мексики. Однако опыты, проведенные в Польше и СССР, опровергли это мнение. В народной Польше этим методом уже добывают большое количество серы; в 1968. году пущены первые серные скважины и в СССР.
А руду, полученную в карьерах и шахтах, приходится перерабатывать (часто с предварительным обогащением), используя для этого различные технологические приемы.
Известно несколько методов получения серы из серных руд: пароводяные, фильтрационные, термические, центрифугальные и экстракционные.
Термические методы извлечения серы - самые старью. Еще в XVIII веке в Неаполитанском королевстве выплавляли серу в кучах -«сольфатарах». До сих пор в Италии выплавляют серу в примитивных печах - «калькаронах». Тепло, необходимое для выплавления серы из руды, получают, сжигая часть добытой серы. Процесс этот малоэффективен, потери достигают 45%.
Италия стала родиной и пароводяных методов извлечения серы из руд. В 1859 году Джузеппе Джилль получил патент на свой аппарат - предшественник нынешних автоклавов. Автоклавный метод (значительно усовершенствованный, конечно) используется и сейчас во многих странах.
В автоклавном процессе обогащенный концентрат серной руды, содержащий до 80% серы, в виде жидкой пульпы с реагентами подается насосами в автоклав. Туда же под давлением подается водяной пар. Пульпа нагревается до 130° С. Сера, содержащаяся в концентрате, плавится и отделяется от породы. После недолгого отстоя выплавленная сера сливается. Затем из автоклава выпускаются «хвосты»-взвесь пустой породы в воде? Хвосты содержат довольно много серы и вновь поступают на обогатительную фабрику.
В России автоклавный способ был впервые применен инженером К. Г. Паткановым в 1896 году.
Современные автоклавы - это огромные аппараты высотой с четырехэтажный дом. Такие автоклавы установлены, в частности, на сероплавильном заводе Роздольского горнохимического комбината в Прикарпатье.
На некоторых производствах, например на крупном серном комбинате в Тарнобжеге (Польша), пустую породу отделяют от расплавленной серы на специальных фильтрах. Метод разделения на специальных центрифугах разработан недавно в нашей стране. Словом, «руду золотую (точнее - золотистую) отделять от породы пустой» можно по-разному.
По-разному и удовлетворяют свои потребности в сере разные страны. Мексика и США используют в основном метод Фраша. Италия, занимающая по добыче серы третье место среди капиталистических государств, продолжает добывать и перерабатывать (разными методами) серные руды сицилийских месторождений и провинции Марко. У Японии есть значительные запасы серы вулканического происхождения. Франция и Канада, не имеющие самородной серы, развили крупное производство, ее из газов. Нет собственных серных месторождений и в Англии и Германии. Свои потребности в серной кислоте они покрывают за счёт переработки серосодержащего сырья (преимущественно пирита), а элементарную серу импортируют.
Россия полностью удовлетворяют свои потребности благодаря собственным источникам сырья. После открытия и освоения богатых Прикарпатских месторождений СССР и Польша значительно увеличили производство серы. Эта отрасль промышленности продолжает развиваться. Были построены новые крупные предприятия на Украине, реконструированы старые комбинаты на Волге и в Туркмении, расширено производство серы из природного газа и отходящих газов.
Возможно, будет полезно почитать:
- Патриарх кирилл запретил актеру и священнику ивану охлобыстину служить в церкви Охлобыстин церковный сан ;
- Иван охлобыстин - биография, информация, личная жизнь Почему охлобыстин ушел из священников ;
- Ужин для ребенка 4 лет рецепты меню ;
- Принципы функционирования бюджетной системы РФ ;
- Особенности размещения населения на территории земли Население земли размещается равномерно средняя плотность населения ;
- Тонька-пулеметчица — cтрашная судьба страшного человека Фильм палач тонька пулеметчица реальная история ;
- Как поздравить начальницу с юбилеем? ;
- Российские студенты выиграли чемпионат мира по программированию Вот они, герои ;