Как из серы получить сероводород уравнение реакции. Особенности технологии получения элементарной серы на установках клауса из сероводорода кислых газов
Изобретение относится к области химии и может быть использовано для получения серы. Серу получают одностадийным окислением сероводорода хлором в газовой фазе с выделением серы и хлороводорода. Смесь хлороводорода и водорода при объемном отношении 8:1 направляют на хлорирование оксида железа (III) при температуре 1000-1200°С. Образующийся хлорид железа (II) выделяют из газовой смеси продуктов реакции и окисляют кислородом для получения хлора, возвращаемого на стадию окисления сероводорода, и оксида железа. Полученный оксид железа (III) возвращают на стадию хлорирования. Изобретение позволяет получать серу из сероводорода с высокой удельной производительностью без использования катализаторов и прямых затрат электрической энергии. 2 пр.
Изобретение относится к области химической технологии неорганических веществ, в частности к получению элементной серы.
Известен способ получения серы из сероводорода методом его термического разложения (US Patent 4302434 (1981)). Способ заключается в том, что газ, содержащий сероводород, пропускают через зону разложения при температуре 850-1600°С, а на выходе из нее охлаждают до 110-150°С, в результате чего высаждается элементная сера. Недостатками этого способа являются высокая энергоемкость и неполнота извлечения сероводорода из исходного газа в результате неполной термической диссоциации и частичной рекомбинации молекул водорода и серы при охлаждении.
Известен плазменный способ получения серы и водорода из сероводорода (Патент Франции 2620436 (1989)). Он заключается в том, что полученную в плазменной горелке плазму смешивают с сероводородсодержащим газом. Температура смеси может достигать таких значений, при которых практически весь сероводород находится в диссоциированном состоянии. Затем продукты диссоциации резко охлаждают, выводят из зоны реакции и разделяют. Недостатком этого способа является невозможность эффективного использования в качестве сырья газов с низким содержанием сероводорода ввиду чрезмерного повышения удельных энергозатрат на конверсию сероводорода в таких смесях.
Более экономичным по затратам электрической энергии является плазмохимический способ получения серы и водорода из сероводорода с использованием неравновесной плазмы, селективно воздействующей на молекулы H 2 S (Патент РФ 2131396 (1999)). Плазма, содержащая атомарный водород, смешивается с сероводородсодержащим газом в быстропроточном реакторе за пределами разрядного промежутка. Использование водорода в термически диссоциированном состоянии в качестве газа для создания плазмы позволяет снизить энергозатраты на проведение процесса и обеспечить полную конверсию сероводорода в газовых смесях, в том числе и с низким его содержанием. Условия осуществления неравновесного плазмохимического процесса в быстропроточном реакторе подбираются таким образом, чтобы обеспечить смешение плазмы водорода с сероводородсодержащим газом за времена значительно более короткие, чем времена рекомбинации активных частиц. Это оказывается возможным сделать при давлении в реакторе 5-50 кПа и энергозатратах до 3,7 кВт*ч/кг H 2 S.
Общим недостатком всех известных способов термического разложения сероводорода являются высокие удельные затраты тепловой или электрической энергии. Снижение затрат с помощью использования неравновесной плазмы и дополнительно плазменной центрифуги для «горячей» закалки продуктов диссоциации (Патент РФ 2129584 (1999)) требует многократного снижения давления в реакторе по сравнению с нормальным давлением и тем самым снижает их удельную производительность и технологическую привлекательность для производства. При этом прямые затраты электрической энергии оказываются достаточно высокими.
Указанных недостатков лишены химические способы конверсии сероводорода. Наиболее известным способом получения элементной серы из сероводорода является процесс Клауса (Химическая технология неорганических веществ. Кн.2. Учеб. пособие / под ред. Т.Г.Ахметова. - М.: Высш. шк., 2002. - 533 с.). Сероводород разделяют на два потока и большую его часть окисляют кислородом воздуха в топке реактора-генератора при температуре 900-1300°С с образованием серы, оксида серы (IV) и паров воды. Из продуктов реакции выделяют элементную серу, а газовую фазу направляют на последующие каталитические ступени окисления оставшегося количества сероводорода. Недостатками способа являются многостадийность процесса, энергоемкость и наличие выхлопных газов, содержащих сернистые соединения.
Известны различные способы многоступенчатого окисления сероводорода кислородом при температуре 250-350°С в псевдоожиженном слое катализатора, при этом общая степень превращения сероводорода достигает 97-99% (Патенты РФ 2057061, 2041163). Недостатками этих способов является невысокая удельная производительность процесса, необходимость регенерации катализатора, сложность поддержания режима псевдоожиженного слоя.
Общим недостатком способов получения серы прямым окислением сероводорода кислородом при температурах 200-400°С является необходимость использования специального катализатора, поскольку при высоких температурах (900-1300°С), когда отпадает необходимость в применении катализаторов, реакция окисления идет с очень малым выходом по сере в термодинамически равновесных условиях.
Наиболее близким к предлагаемому изобретению является способ окисления сероводорода хлором в газовой фазе (A.V.Sims, I.Sheinbaum. The direct chlorination process for geothermal power plant off-gas - hydrogen sulfide abatement. Report for The United States Department of Energy. Contract DE-AC03-82SF-11664. June, 1983). Реакция окисления сероводорода хлором не требует использования катализатора и при смешении газов протекает самопроизвольно со значительным выделением тепловой энергии. В режиме горения в зоне реакции температура газов может достигать 1100°С. Степень превращения сероводорода в серу в одну стадию составляет 99,8%. После выделения элементной серы из газовой фазы хлороводород поглощается водой, а затем полученный раствор соляной кислоты подвергается электролизу с целью регенерации хлора. Однако использование стадии электролиза приводит к значительным прямым затратам электрической энергии и невысокой общей удельной производительности процесса.
Предлагаемое изобретение направлено на разработку высокопроизводительного процесса получения серы из сероводорода с использованием в качестве реагентов водорода, кислорода воздуха и рециклируемых в процессе хлора и оксида железа (III). Поставленная задача решается путем окисления сероводорода хлором в газовой фазе, выделения серы и рециклинга хлора из хлороводорода в двустадийном процессе железоводородной конверсии.
Сероводород и хлор с объемным отношением 1:1 подаются в реактор окисления при температуре >150°С и давлении 0,1 МПа, где протекает реакция
H 2 S+Cl 2 =S+2HCl
При строгой дозировке сероводорода и хлора попутного образования хлоридов серы не наблюдается. После выделения элементной серы из газовой фазы хлороводород направляется на двустадийную железоводородную конверсию для регенерации хлора.
На первой стадии железоводородной конверсии хлороводорода во вращающуюся печь при температуре 1000-1200°С через дозирующее устройство подается гранулированный оксид железа (III). В противоточном режиме твердый оксид железа (III) хлорируется газовой смесью хлороводорода и водорода при объемном соотношении 8:1, давлении 0,1 МПа по реакции
После понижения температуры газовой смеси продуктов реакции до 500-600°С из нее выделяется твердый хлорид железа (II), а смесь избыточного хлороводорода и паров воды поступает на разделение, после которого осушенный газообразный хлороводород возвращается на стадию хлорирования.
На второй стадии процесса конверсии твердый хлорид железа (II) испаряется при температуре 1000-1200°С и подается в реактор окисления, где смешивается с кислородом:
Для ускорения процесса нуклеации макрочастиц в поток рекомендуется вводить зародыши оксида железа (III). После выделения из газовой фазы твердый оксид железа (III) подвергается гранулированию и возвращается на стадию хлорирования.
Регенерированный газообразный хлор возвращается в реактор окисления сероводорода.
Удельная производительность процесса железоводородной конверсии на стадии хлорирования оксида железа (III) по связанному хлору может достигать величины 130 т/(м 3 *ч) Cl 2 . Стадия окисления хлорида железа (II) кислородом в газовой фазе является лимитирующей в общем процессе, и удельная производительность реактора окисления может достигать величины 3 т/(м 3 *ч) Cl 2 . Расход водорода на регенерацию 1 т хлора составляет 14,1 кг, расход кислорода 677 кг.
Расход реагентов на получение 1 т серы составляет 31,3 кг водорода и 1,5 т кислорода.
При температуре 150°С и давлении 0,1 МПа в реактор окисления подаются сероводород со скоростью 263,5 дм 3 /с и хлор со скоростью 263,5 дм 3 /с. В результате реакции образуется элементная сера со скоростью 0,38 кг/с и хлороводород со скоростью 527 дм 3 /с. После выделения серы из газовой фазы хлороводород направляется на двустадийную железоводородную конверсию.
Во вращающуюся трубчатую печь при температуре 1100°С подается гранулированный оксид железа со скоростью 0,94 кг/с. В противотоке при давлении 0,1 МПа в печь подается газовая смесь хлороводорода и водорода с отношением 8:1 со скоростью 1186 дм 3 /с. На выходе печи образуется хлорид железа (II) со скоростью 1,49 кг/с и газовая смесь хлороводорода и паров воды с отношением 2:1,5 со скоростью 922,3 дм 3 /с. При температуре 550°С хлорид железа (II) конденсируется из газовой фазы и транспортируется в испаритель. После отделения воды циркулирующий газообразный хлороводород со скоростью 527 дм 3 /с возвращается в смеситель для получения водород-хлороводородной хлорирующей газовой смеси.
В реактор окисления объемом 1 м 3 при температуре 1100°С и давлении 0,1 МПа из испарителя подается газообразный хлорид железа (II) со скоростью 263,5 дм 3 /с и кислород со скоростью 395,2 дм 3 /с. На выходе реактора образуется хлор со скоростью 263,5 дм 3 /с и оксид железа со скоростью 0,94 кг/с. Твердый оксид железа (III) подвергается гранулированию и возвращается в дозирующее устройство на стадию хлорирования.
Общий расход реагентов: сероводород 263,5 дм 3 /с, водород 131,8 дм 3 /с, кислород 395,3 дм/с.
При температуре 150°С и давлении 0,1 МПа в реактор окисления подаются сероводород со скоростью 790,5 дм 3 /с и хлор со скоростью 790,5 дм 3 /с. В результате реакции образуется элементная сера со скоростью 1,14 кг/с и хлороводород со скоростью 1581 дм 3 /с. После выделения серы из газовой фазы хлороводород направляется на двустадийную железоводородную конверсию.
Во вращающуюся трубчатую печь при температуре 1100°С подается гранулированный оксид железа со скоростью 2,81 кг/с. В противотоке при давлении 0,1 МПа подается газовая смесь хлороводорода и водорода с отношением 8:1 со скоростью 3557 дм 3 /с. На выходе печи образуется хлорид железа (II) со скоростью 4,47 кг/с и газовая смесь хлороводорода и паров воды с отношением 2:1,5 со скоростью 2767 дм 3 /с. При температуре 550°С хлорид железа (II) конденсируется из газовой фазы и транспортируется в испаритель. После отделения воды циркулирующий газообразный хлороводород со скоростью 1581 дм 3 /с возвращается в смеситель для получения водород-хлороводородной хлорирующей газовой смеси.
Вообще, вопрос, касающийся того, как получить серу достаточно интересный и занимательный, хотя бы, потому что сера входит в состав не только горных и природных пород и необходима для жизни человека, но и входит в состав самого организма человека. Сера является типичным неметаллом и горючим химическим элементом. С давних времен люди использовали серу в быту и находили способы по ее добыче. На данный момент времени открыто множество способов получения серы.
Самым распространенным способом получения серы является метод, предложенный еще в 1890 г. Г.Фаршем. Он предложил плавить серу под землей и с помощью скважин выкачивать ее на поверхность. Идея заключалась в том, что сера – легкоплавкий химический элемент, температура плавления которого 113 0 С, что значительно облегчает процесс возгонки. На основе предложенной идеи возникли разные методы получения серы из серных руд и горных залежей:
- пароводяной,
- фильтрационный,
- термический,
- центрфугальный,
- экстрационный.
Все эти способы и методы широко используются в горнодобывающей промышленности. Также популярен способ добычи химически чистой мелкодисперсной серы из природного газа, которая является идеальным сырьем в химической и резиновой промышленности. Так как сера в больших количествах содержится в газообразном виде в природном газе, то при добыче газа она оседает на стенках труб, быстро выводя их из строя. Поэтому нашелся способ улавливать ее сразу после добычи газа.
Как получить оксид серы
Оксид серы (VI) – легколетучая бесцветная жидкость с удушающим резким запахом. Самые простые и распространенные способы получения оксида серы:
- В присутствии катализатора при нагревании окисляют оксид серы (IV) воздухом, получая тем самым оксид серы (VI).
- Термическим разложением сульфатов.
- Оксид серы (IV) окисляют озоном до получения оксида серы (VI).
- В реакции окисления оксида серы (IV) используют оксид азота, тем самым получая оксид серы (VI).
Как получить оксид серы 4
Оксид серы (IV), или сернистый газ - бесцветный газ с характерным удушающим запахом. В лабораторных условиях оксид серы (IV) получают взаимодействием гидросульфита натрия с серной кислотой или нагреванием меди с концентрированной серной кислотой. Также в природе и лабораторных условиях распространен способ получения оксида серы (IV) воздействием сильных кислот на сульфиты и гидросульфиты. В результате такой реакции образуется сернистая кислота, которая сразу же разлагается на воду и оксид серы (IV). Промышленный способ получения оксида серы (IV) – сжигание серы или обжиг сульфидов – пирита.
Как из сероводорода получить серу
Способ получения серы из сероводорода проводится в лабораторных условиях. Следует сразу отметить, что подобный способ получения серы следует проводить при всех мерах безопасности, так как сероводород – это активное и ядовитое вещество. Суть метода заключается во взаимодействии (реакции) сероводорода с серной кислотой, в результате чего образуется вода, диоксид серы, газ и мелкодисперсная сера, которая останется на дне пробирки в конце реакции в виде осадка. Полученный осадок фильтруют, промывают и дают ему высохнуть. Это и будет мелкодисперсная сера.
УДК 661.214.232
ОСОБЕННОСТИ ТЕХНОЛОГИИ ПОЛУЧЕНИЯ ЭЛЕМЕНТАРНОЙ СЕРЫ НА УСТАНОВКАХ КЛАУСА ИЗ СЕРОВОДОРОДА КИСЛЫХ ГАЗОВ
Аяпбергенов Ерболат Озарбаевич
АО "КазНИПИмунайгаз"
Магистр техники и технологии
Аннотация
В данной работе описаны особенности технологии получения элементарной серы на установках Клауса из сероводорода кислых газов.
FEATURES OF TECHNOLOGY OF ELEMENTAL SULFUR TO HYDROGEN SULFIDE CLAUS PLANTS OF ACID GASES
Ayapbergenov Erbolat Ozarbaevich
AO "KazNIPImunaygaz"
master of technics and technology
Abstract
Article is about features of technology of elemental sulfur to hydrogen sulfide Claus plants of acid gases.
Библиографическая ссылка на статью:
Аяпбергенов Е.О. Особенности технологии получения элементарной серы на установках Клауса из сероводорода кислых газов // Современные научные исследования и инновации. 2012. № 10 [Электронный ресурс]..09.2017).
Сероводородные газы, образующиеся в процессе очистки углеводородных газов от кислых компонентов, обычно перерабатываются в серную кислоту или элементарную серу. Для утилизации сероводородного газа в элементарную серу обычно применяется хорошо известный в мировой практике процесс Клауса или его различные модификации. В настоящее время почти весь объем промышленного получения серы получается на основе этого процесса. Утилизация серы из перерабатываемой нефти имеет огромное природоохранное значение .
Сущность процесса Клауса заключается в переработке сероводородного газа в серу по окислительному методу с применением термической и двух-трех каталитических ступеней .
Поступающий на установку Клауса кислый газ подвергается высокотемпературному (900 – 1300°С) сжиганию в свободном пламени в присутствии стехиометрического количества воздуха с получением элементарной серы (выход до 70%) и диоксида серы в соответствии с уравнениями :
, (1)
. (2)
Принято считать, что при стехиометрическом количестве кислорода в топке часть H 2 S реагирует по реакции (1), а треть непрореагировавшего H 2 S – по реакции (2). Поэтому на выходе из топки в газах соотношение H 2 S/SO 2 получается равным 2.
Однако представляется более правильным образование серы через моноокись серы. Тогда механизм пламенного сжигания сероводорода будет выражаться следующими уравнениями:
![]() , (3)
, (3)
![]() , (4)
, (4)
![]() , (5)
, (5)
Реакция (3) и (4) протекают с большой скоростью, поэтому выход серы будет лимитироваться скоростью реакции (5).
Получаемый по реакции (2) сернистый ангидрид окисляется на бокситовом катализаторе гидроаргиллитовой структура при температуре 370 – 400°С по реакциям:
, (6)
, (7)
Реакция идет частично на термической стадии при охлаждении газового потока, но в большем объеме – на стадии каталитического окисления.
Подача воздуха в камеру сгорания ведется с таким расчетом, чтобы на выходе из печи соотношение H 2 S:SО 2 составляло 2:1 (в соответствии с последующей реакцией каталитического окисления сероводорода диоксидом серы). Содержание кислорода в отходящих газах должно быть сведено к минимуму, так как его наличие способствует сульфатации катализатора на основе оксида алюминия.
На всех стадиях процесса степень превращения сероводорода стремятся довести до состояния термодинамического равновесия. Равновесная конверсия сероводорода в серу в интервале температур 150 ÷ 1300°С представлена на рисунке 1.
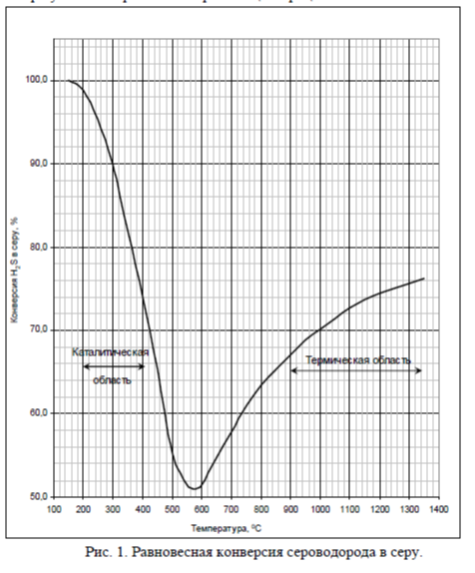
Рисунок 1. – Температурная зависимость термодинамически равновесной степени превращения H 2 S в парообразную элементарную серу
В процессе Клауса реакции протекают в трех зонах: 1 – высокотемпературная (выше 800°С), где превращение H 2 S в серу достигает 70 – 80% и возрастает с повышением температуры, так как сероводород начинает разлагаться на элементы; 2 – переходная зона, в которой снижение выхода серы при температуре 530 – 730°С обусловливается ассоциацией серы вида S 2 в более высокомолекулярные виды S 4 , S 6 , S 8 ; 3 – низкотемпературная каталитическая зона, в которой снижение температуры повышает степень конверсии.
Реакции в пламени ведут к превращению сероводорода в элементарную серу, образованию диоксида серы и разрушению примесей, которые могли бы дезактивировать катализатор. В высокотемпературной зоне пламени образуется сера в виде S 1-2 в низкотемпературной – S 3-8 .
Присутствие в кислом газе так называемые нежелательные компоненты (СО 2 , пары воды и углеводороды) могут вступать в побочные реакции, приводящие к снижению конверсии сероводорода в серу и образованию соединений, которые могут вступать в реакции образования серы на последующих (каталитических) стадиях процесса :
Углеводороды сгорают с образованием СО 2 , СО, Н 2 О, Н 2 . При высоких температурах в пламени в результате взаимодействия углеводорода с парами серы образуется сероуглерод:
![]() ,
,
![]() ,
,
![]() .
.
Свободный водород, образовавшийся при термической диссоциации сероводорода, восстанавливает диоксид углерода до оксида, который, взаимодействуя с серой, образует серооксид углерода:
;
![]() ;
;
![]() .
.
При понижении температуры газа реакция ведет в обратном направлении с образованием сероводорода, однако скорость обратной реакции с понижением температуры замедляется. Для полной конверсии сероокиси углерода необходимо проводить ее на катализаторе при температуре не ниже 350°С. Бокситовый катализатор, который применяется для контактного окисления сероводорода, может быть эффективен и для конверсии сероокиси углерода, однако наибольшая конверсия будет в случае применения активной Al 2 O 3:
;
.
В связи с этим наиболее распространена схема с двумя каталитическими ступенями. При конвертировании газов, содержащих сероокись углерода, температура, до которой следует нагревать газы, поступающие в конвертор 1 ступени, принимается 230 – 280°С с тем, чтобы температура газов на выходе из 1-го конвертора была не менее 350°С для достижения полноты реакций взаимодействия COS и SO 2 .
Изучение механизма образования сероуглерода и серооксида углерода показало, что они образуются автономно. Образованию сероуглерода способствуют, в основном, ароматические углеводороды.
Вследсвие высокого содержания водяных паров в газе, полученном на термической стадии и поступающем в каталитический конвертор, CS 2 и COS в присутствии катализаторов процесса частично гидролизуются. Скорость гидролиза возрастает с повышением температуры в конверторе (так, скорость гидролиза CS 2 возрастает примерно вдвое на каждые 20°С). Температуру на выходе из первого конвертора поддерживают в пределах 320 – 360°С, при этом степень превращения COS достигает 90%, CS 2 – 70 – 75% (несмотря на это, потери серы в виде CS 2 и COS очень ощутимы).
Присутствие аммиака в поступающем на установку кислом газе, в случае если он целиком или частично проходит через печь не сгорая, также приводит к возникновению вторичных реакций образованию (за счет реакции с серой) отложений твердых аммонийных комплексов на самых холодных участках установки, возможному образованию оксида азота в присутствии кислорода, способствующего окислению диоксида серы в триоксид. Последний при взаимодействии с водой образует серную кислоту, которая наряду с коррозионными проблемами усиливает сульфатирование катализатора – оксида алюминия. В целях предотвращения этих реакций, необходимо удалять аммиак из сырьевого потока на стадии термического сжигания .
![]() ;
;
![]() ;
;
![]() ;
;
![]() .
.
Сера обладает меньшей летучестью, чем другие компоненты газовой смеси, поэтому из технологического потока ее выводят конденсацией после реакционной печи и каждого каталитического конвертора. Это позволяет сдвигать равновесие реакции в сторону образования серы и уменьшать точку росы серы в газах, что, в свою очередь, дает возможность снизить температуру в каталитических конверторах, избегая осаждения серы на катализатор. Этот принцип лежит в основе работы каталитических стадий установок Клауса.
На основании термодинамических расчетов некоторые исследователи рекомендуют использование трех или четырех каталитических конверторов, работающих в стационарных условиях при весьма низкой температуре. В этом случае возможно достижение суммарного выхода серы, превышающего. Однако при современной технологии эти результаты не достигаются вследствие кинетических ограничений, например из-за отложения серы в порах катализатора .
Библиографический список
Абросимов А.А. Экология переработки углеводородных систем. М.: Химия, 2002, 608 с.
Банов П.Г. Процессы переработки нефти. М.: ЦНИИТЭнефтехим, 2003, Ч3, 504 с.
Чуракаев А.М. Переработка нефтяных газов. М.: Недра, 1983, 279 с.
Николаев В.Ю., Ляхов В.Д. Современная техника и технология производства газовой серы // Переработка газа и газового конденсата: науч.-технич. обз., М.: ВНИИЭгазпром, 1975, 60 с.
Широкова Г.С. Современные тендеции в развитии процесса Клауса. Пути решения задач по оптимизации работы установок производства серы // Материалы докладов международной конференции «Топливо и экология – 2009», М., 2009, С: 7 – 14.
Немировский М.С., Вихман А.Г., Мириманян А.А. Установка Клауса и выбросы диоксида азота // Нефтепереработка и нефтехимия, 2007, №12, С: 13 – 15.
Балыбердина И.Т. Физические методы переработки и использования газа. М.: Недра, 1988, 248 с.
Николаев В.В., Бусыгина Н.В., Бусыгин И.Г. Основные процессы физической и физико-химической переработки газа. М.: Недра, 1998, 184 с.
Щурин Р.М., Онопко Т.В., Калинина Н.В., Плинер В.М. Производство газовой серы методом Клауса // Промышленная и санитарная очистка газов обз. информация, М.: ЦИНТИХИМНефтемаш, 1986, 37 с.
Широкова Г.С. Переработка сероводородных газов в элементарную серу // Материалы докладов международной конференции «Топливо и экология – 2008», М., 2008, С: 48 – 51.
Возможно, будет полезно почитать:
- Патриарх кирилл запретил актеру и священнику ивану охлобыстину служить в церкви Охлобыстин церковный сан ;
- Иван охлобыстин - биография, информация, личная жизнь Почему охлобыстин ушел из священников ;
- Ужин для ребенка 4 лет рецепты меню ;
- Принципы функционирования бюджетной системы РФ ;
- Особенности размещения населения на территории земли Население земли размещается равномерно средняя плотность населения ;
- Тонька-пулеметчица — cтрашная судьба страшного человека Фильм палач тонька пулеметчица реальная история ;
- Как поздравить начальницу с юбилеем? ;
- Российские студенты выиграли чемпионат мира по программированию Вот они, герои ;