Расчет по уравнению реакции. Расчеты по химическим уравнением
Тема: Вещества и их превращения
Урок: Расчеты по уравнению химической реакции
Рассмотрим уравнение реакции образования воды из простых веществ:
2H 2 + O 2 = 2H 2 O
Можно сказать, что из двух молекул водорода и одной молекулы кислорода образуется две молекулы воды. С другой стороны, эта же запись говорит о том, что для образования каждых двух молей воды нужно взять два моля водорода один моль кислорода.
Мольное соотношение участников реакции помогает производить важные для химического синтеза расчеты. Рассмотрим примеры таких расчетов.
ЗАДАЧА 1. Определим массу воды, образовавшуюся в результате сгорания водорода в 3,2 г кислорода
.
Чтобы решить эту задачу, сначала необходимо составить уравнение химической реакции и записать над ним данные условия задачи.
Если бы мы знали количество вещества вступившего в реакцию кислорода, то смогли бы определить количество вещества воды. А затем, рассчитали бы массу воды, зная ее количество вещества и . Чтобы найти количество вещества кислорода, нужно массу кислорода разделить на его молярную массу.
Молярная масса численно равна относительной . Для кислорода это значение составляет 32. Подставим в формулу: количество вещества кислорода равно отношению 3,2 г к 32 г/моль. Получилось 0,1 моль.
Для нахождения количества вещества воды оставим пропорцию, используя мольное соотношение участников реакции:
на 0,1 моль кислорода приходится неизвестное количество вещества воды, а на 1 моль кислорода приходится 2 моля воды.
Отсюда количество вещества воды равно 0,2 моль.
Чтобы определить массу воды, нужно найденное значение количества воды умножить на ее молярную массу, т.е. умножаем 0,2 моль на 18 г/моль, получаем 3,6 г воды.
Рис. 1. Оформление записи краткого условия и решения Задачи 1
Помимо массы, можно рассчитывать объем газообразного участника реакции (при н.у.), используя известную вам формулу, в соответствие с которой объем газа при н.у. равен произведению количества вещества газа на молярный объем. Рассмотрим пример решения задачи.
ЗАДАЧА 2. Рассчитаем объем кислорода (при н.у.), выделившийся при разложении 27г воды.
Запишем уравнение реакции и данные условия задачи. Чтобы найти объем выделившегося кислорода, нужно найти сначала количество вещества воды через массу, затем по уравнению реакции определить количество вещества кислорода, после чего можно рассчитать его объем при н.у.
Количество вещества воды равно отношению массы воды к ее молярной массе. Получаем значение 1,5 моль.
Составим пропорцию: из 1,5 моля воды образуется неизвестное количество кислорода, из 2 молей воды образуется 1 моль кислорода. Отсюда количество кислорода равно 0,75 моля. Рассчитаем объем кислорода при н.у. Он равен произведению количества кислорода на молярный объем. Молярный объем любого газообразного вещества при н.у. равен 22,4 л/моль. Подставив числовые значения в формулу, получим объем кислорода, равный 16,8 л.

Рис. 2. Оформление записи краткого условия и решения Задачи 2
Зная алгоритм решения подобных задач, можно рассчитать массу, объем или количество вещества одного из участников реакции по массе, объему или количеству вещества другого участника реакции.
1. Сборник задач и упражнений по химии: 8-й кл.: к учеб. П.А. Оржековского и др. «Химия. 8 класс» / П.А. Оржековский, Н.А. Титов, Ф.Ф. Гегеле. - М.: АСТ: Астрель, 2006. (с.40-48)
2. Ушакова О.В. Рабочая тетрадь по химии: 8-й кл.: к учебнику П.А. Оржековского и др. «Химия. 8 класс» / О.В. Ушакова, П.И. Беспалов, П.А. Оржековский; под. ред. проф. П.А. Оржековского - М.: АСТ: Астрель: Профиздат, 2006. (с. 73-75)
3. Химия. 8 класс. Учеб. для общеобр. учреждений / П.А. Оржековский, Л.М. Мещерякова, М.М. Шалашова. - М.:Астрель, 2013. (§23)
4. Химия: 8-й класс: учеб. для общеобр. учреждений / П.А. Оржековский, Л.М. Мещерякова, Л.С. Понтак. М.: АСТ: Астрель, 2005. (§29)
5. Химия: неорган. химия: учеб. для 8кл. общеобр. учрежд. /Г.Е. Рудзитис, Ф.Г. Фельдман. - М.: Просвещение, ОАО «Московские учебники», 2009. (с.45-47)
6. Энциклопедия для детей. Том 17. Химия / Глав. ред.В.А. Володин, вед. науч. ред. И. Леенсон. - М.: Аванта+, 2003.
Дополнительные веб-ресурсы
2. Единая коллекция цифровых образовательных ресурсов ().
Домашнее задание
1) с. 73-75 №№ 2, 3, 5 из Рабочей тетради по химии: 8-й кл.: к учебнику П.А. Оржековского и др. «Химия. 8 класс» / О.В. Ушакова, П.И. Беспалов, П.А. Оржековский; под. ред. проф. П.А. Оржековского - М.: АСТ: Астрель: Профиздат, 2006.
2) с.135 №№ 3,4 из учебника П.А. Оржековского, Л.М. Мещеряковой, М.М. Шалашовой «Химия: 8кл.», 2013 г.
2.3.1. Последовательно протекающие реакции (составление «стехиометрических схем»).
В задачах, представленных в настоящем разделе, требуется составить не одну,адвеилиболеепропорций.Обычношкольникихорошосправляютсясзадачами, в которых требуется составить одну пропорцию, они иногда даже умеют преобразовать данные из условия в явный вид, но часто теряются и испытывают трудности, когда исходное вещество отстоит от продукта реакции на несколько уравнений происходящих процессов.
В следующем разделе будут случаи, когда параллельно происходит пара (или больше) реакций, а известна суммарная масса реагирующей (образующейся) смеси .
Первый случай:
Рассмотрим пример, когда условие задачи сформулировано в общем виде (все вещества известны).
«Из вещества E получаютA, которое реагирует с веществом B с образованием продуктов C и D. Дается m(E) – масса вещества E. Требуется определить m(C)
– массу вещества C».
Составим схемы превращений и напишем уравнение реакций:
aA+ bB = cC + dD | |
По уравнению (1) составим пропорцию: | |
из eM(E) г вещества E образуется | kM(A) г веществаA, |
из m(E) г вещества E образуется | m(A) г веществаA, |
m(A) = m(E)kM(A) | |
Из уравнения (2) имеем пропорцию: | |
из aM(A) г веществаAобразуется | cM(C) г вещества C, |
из m(A) г веществаAобразуется | m(C) г вещества C, |
m(C) = m(A)cM(C) aM(A)
Именно так каждый второй школьник подойдет к решению подобных задач сначала будет считать по первой реакции, затем по второй. А если стадий 10? Используя элементарную математику, можно все это упростить.
Подставляя значение m(A), полученное из первой пропорции, в выражение для m(C) из второй, приходим к выражению:
c M(C) | ||||||||
Таким образом, исключив m(A) и M(A) из суммарного уравнения, мы выяснили, что рассчитывать m(A) (промежуточное соединение) совершенно нет необходимости. Это и есть то самое дополнительное неизвестное, которого следует избегать. Из последнего соотношения видно, что его можно было получить, приведя в соответствие коэффициенты обоих уравнений реакции и сложив их левые и правые части, как это всегда делают при уравнении окислительно-восстановительных реакций:
eE $ kA
aA+ bB = cC + dD
eE $ kA
KA+kb a B= kA+ kC a C+ kd a D
Отметим для поборников физического смысла данного сложения, что суммирование уравнений является формальной математической операцией и не подразумевает суммирования обоих уравнений химических реакций.
Исключив A и параметры, по которым не ведется расчет (B, D), получим
m(C) = k c m(E) M(C) . e a M(E)
Можно показать, что задача с цепочкой из трех уравнений решается аналогично. Рассмотрим пример:
«Определить m(F), если имеется цепочка превращений: eE $ kA(1);
aA $ cC (2); nC$ fF (3)
и, кроме коэффициентов a – n, известна масса m(E)».
Решение этой задачи сводится к следующему. Домножим уравнение (2) на k/a, чтобы исключитьA, а уравнение (3) на (k/a)(c/f), получаем
eE $ kA, kA$ kc a C,

eE = kcf an F.
Эту стехиометрическую схему можно распространить на какое угодно число стадий цепочки. В общем виде это выглядит так:
произведение коэффициентов в правых частях уравнений m (продукта) = _________________________________________________ х
произведение коэффициентов в левых частях уравнений
х m(исходного). M(продукта). M(исходного)
Обратное соотношение имеет вид:
произведение коэффициентов в левых частях уравнений m (исходного) = __________________________________________________ х
произведение коэффициентов в правых частях уравнений
х m(продукта). M(исходного). M(продукта)
Расчет в молях приводит к аналогичному результату:
По уравнению (1):
из e моль E образуется k мольA
из m(E) моль E образуется x мольA
x = eM km((E E ) ) моль.
По уравнению (2):
из a мольAобразуется c моль C из x мольAобразуется y моль C.
Как и в предыдущем случае, в результирующей формуле участвуют только коэффициенты при веществах, которые составляют саму цепочку, и отсутву-
![]()
ют промежуточные расчеты.
Пример 1. Определите массу бертолетовой соли, которую нужно разложить для выделения кислорода, необходимого для получения 10,2 г оксида алюминия из чистого металла.
Решение. Уравнения реакций:
2KClO3 = 2KCl + 3O2 3O2 + 4Al = 2Al2 O3
По выведенным соотношениям стехиометрическая схема имеет вид: 2KClO3 2Al2 O3 , или KClO3 Al2 O3 ;
m(KClO3 )=m(Al 2 O 3 )M(KClO 3 ) = 10,2 122,5 = 12,25 (г). M(Al 2 O 3 ) 102
Пример 2 . Рассчитайте, сколько граммов н-гептана потребуется для получения из него толуола в результате циклизации и дегидрирования, так чтобы выделившегося при этом водорода было достаточно для гидрирования 42 г гексена-1. Сколько толуола при этом получается? Считать, что все реакции идут с количественным выходом.
Решение. Протекают реакции:
Гексена-1– 42/84 = 0,5 моль. Следовательно, H2 потребуется 0,5 моль. При этом образуется 0,5/4 = 0,125 моль толуола (0,125. 92 = 11,5 г), а для его получения требуется 0,125 моль н-гептана (0,125. 100 = 12,5 г).
Пример 3. При полном разложении 98 г бертолетовой соли при определенной температуре выделилось 19,2 г кислорода. Определите состав твердого остатка.
Решение. Составляем уравнения реакций, происходящих при нагревании бертолетовой соли:
2KClO3 | 2KCl+3O2 , | |
4KClO3 | KCl+3KClO4 . |
M(KClO3 ) = 122,5 г/моль; M(KCl) = 74,5 г/моль;
M(O2 ) = 32 г/моль; M(KClO4 ) = 138,5 г/моль.
Находим массу KClO3 , разложившегося по уравнению (1): 2 122,5 г KClO3 –– 3 32 г O2 ,
x г KClO3 –– 19,2 г O2 , x = 49 г KClO3 .
При этом образовалось KCl: 2 74,5 г KCl –– 3 32 г O2 ,
y г KCl –– 19,2 г O2 ,
y = 29,8 г KCl.
По уравнению (2) разложилось 98 – 49 = 49 г KClO3 . Находим массу образовавшегося KCl:
4122,5 г KClO3 –– 74,5 г KCl,
49 г KClO3 | –– x г KCl, |
x = 7,45 г KCl. |
Масса образовавшегося KClO4 :
4122,5 г KClO3 –– 3138,5 г KClO4 , 49 г KClO3 –– y г KClO4 ,
y = 41,55 г KClO4 .
Всего в остатке: 29,8 + 7,45 = 37,25 г KCl и 41,55 г KClO4 .
1. Оксиднатриямассой6.2грастворилив100млводы(раствор 1 ).Затем к раствору1 приливали соляную кислоту с массовой долей 10 % до тех пор, пока реакция среды не стала нейтральной (получен раствор2 ). Определите массовые доли веществ в растворах1 и2 и массу раствора соляной кислоты, пошедшей на нейтрализацию.
2. Сернистый газ, получившийся при сжигании 179,2 л сероводорода (н.у.), пропущен через 2 л 25 %-го раствора гидроксида натрия (ρ =1,28 г/см3 ). Каков состав образующейся соли и какова ее массовая доля в растворе в процентах?
3. Колонна синтеза аммиака дает 1500 т продукта в сутки. Сколько азотной кислоты 50%-ной концентрации можно теоретически получить из этого количества аммиака?
4. Врезультатепрокаливания2мольгидроксидатрехвалентногометалла выделилось a г оксида. Нагреванием а г гидроксида получили b г остатка; после прокаливания b г гидроксида масса остатка составила 82,76 г. Определите формулу гидроксида.
5. Для восстановления 3,2 г оксида металла требуется 1,344 л водорода. При растворении полученного металла в избытке соляной кислоты выделяется 0,896 л водорода. Определите, какой это металл. Напишите уравнения всех упомянутых реакций. (Объемы газов измерены при н.у.).
6. Для получения уксусной кислоты в качестве исходного вещества был использован технический карбид кальция, содержащий 4% примесей. Какое количество карбида было израсходовано, если известно, что на нейтрализацию полученной уксусной кислоты потребовалось 240 г раствора гидроксида

уксусная кислота образуется с выходом 100%.
7. Глицерин обрабатывали концентрированной азотной кислотой в присутствии водоотнимающего вещества. 100 г полученного вещества взорвали, а продукт реакции собрали и пропустили последовательно через растворы щелочи, концентрированной серной кислоты и над нагретой медной спиралью. Оставшийся газ собрали в мерный цилиндр над водой. Какой это газ? Какова его масса и объем (н.у.)? Приведите необходимые уравнения реакций.
8. Пары пропилового спирта пропустили над оксидом алюминия при 300 o C. На полученный продукт подействовали бромидом водорода, затем на образовавшееся вещество – металлическим натрием. Напишите уравнения происходящих реакций и рассчитайте, из какого количества пропилового спирта получится 43 г конечного продукта.
9. Через эквимолярную смесь азота и кислорода длительное время пропускали электрический разряд. Затем смесь медленно привели к комнатной температуре и мелкими частями смешали с небольшим избытком теплого
раствора NaHCO3 . В образовавшемся после реакции растворе практически не было нитрат-ионов, а объем отделившегося газа составлял 5/8 первоначального (объемы измерены в одних и тех же условиях). Определите, какая часть азота прореагировала.
1. Оксид натрия реагирует с водой: Na 2 O + H2 O = 2NaOH
При нейтрализации гидроксида натрия соляной кислотой идет реакция: NaOH + HCl = NaCl + H2 O
Стехиометрическая схема: Na2 O 2NaOH 2NaCl.
Из 6,2/62 = 0,1 моль оксида натрия образуется 0,2 моль, или 0,2 40 = 8,0 г щелочи. Масса раствора1 равна 100 1 + 6,2 = 106,2 (г), и, следовательно, массовая доля NaOH в нем равна:
w (NaOH) =106,2 100 = 7.53 %
На нейтрализацию потребуется 0,2 моль, или 0,2 36.5 = 7,3 (г) кислоты, которая содержится в (100/10) 7.3 = 73 (г) ее раствора.
Масса раствора 2 равна 106,2 + 73 = 179,2 г. В нем растворено 0,2 моль, или
0,2 58.5 = 11,7 (г) поваренной соли с массовой долей11,7 100 = 6.53 %. 179,275
2. Уравнения реакций:
2H2 S + 3O2 = 2SO2 + 2H2 O;
SO2 + 2NaOH = Na2 SO3 + H2 O (при достаточном количестве NaOH) (1)
SO2 + NaOH = NaHSO3 |
Из 179,2 л H2 S получается 179,2 л SO2 , т. е.179 22, , 4 2 = 8 моль; раствор NaOH
содержит 200 1,28 25 = 640 г NaOH, т. е. 640/40 = 16 моль. 100
Следовательно, протекает реакция (1), и образуется соль Na2 SO3 в количестве 8 моль; ее масса – 126 8 = 1008 (г). Масса раствора равна сумме массы раствора щелочи и массы добавленного сернистого газа: 2560 + 8 64 = 3072 (г).
Массовая доля соли равна (1008/3072) 100 = 32,8 (%).
3. Напишем общую схему превращения аммиака в азотную кислоту:
нам даже без записи уравнений можно сразу определить массу 100 %-ной азотной кислоты:
HNO3 |
|||
x = 1500 17 63 = 5553 (т); 50 %-ной HNO3 можно получить вдвое больше: 11106 т.
4. Запишем уравнение реакции разложения гидроксида металла:
2Ме(ОН)3 = Me2 O3 + 3Н2 O.
Обозначим через х г массу 2 моль Me(OH)3 ; тогда 1 моль Me2 O3 будет (х –
Из x г Me(OH)3 образуется (х – 54) г Me2 O3 ;
из (х – 54) г Me(OH)3 ––– (x – 54)2 /x г Me2 O3 ; из (x – 54)2 /x г Me(OH)3 ––– (x – 54)3 /x2 г Me2 O3 ; (x – 54)3 /x2 = 82,76 г; x = 206 г.
M (Me(OH)3 ) = 206/2 = 103;А (Me) = 52; металл – хром. 5. Общие схемы реакций:
Mx Oy + yH2 = xM + yH2 O;
M + nHCl = n/2H2 + MCln . |
|
По условию, y ≠ n/2, т. е. степени окисления в оксиде и хлориде разные. Соотношение объемов водорода равно 1,344/0,896 = 3/2. Отсюда, металл в оксиде имеет валентность 3, а при растворении в кислоте отдает 2 электрона (соотношение валентностей 6/4 маловероятно).
Уравнение реакции:
M2 O3 + 3H2 = 2M + 3H2 O.
Было 1,344/22,4 = 0,06 моль водорода, восстановившего 0,02 моль оксида молярной массы 3,2/0,02 = 160 г/моль.
Решаем уравнение: 2A(M) + 3 16 = 160, откудаA(M) = 56.
Искомый металл – железо: Fe + 2HCl = FeCl2 + H2
6. Уравнения реакций:
CaC2 + 2H2 O = Ca(OH)2 + C2 H2
H2 O, Hg2+
C2 H2 CH3 CHO
CH3 CHO[O] CH3 COOH CH3 COOH + KOH = CH3 COOK + H2 O
Объем раствора 240/1,2 = 200 мл.
1 л –– 5.5 моль,
0,2 л –– x моль, x = 1,1 моль KOH.
1,1 моль KOH нейтрализует 1,1 моль уксусной кислоты. Суммарная схема получения кислоты:
CaC2 H 2 O, [O] CH3 COOH
Из 1 моль CaC2 получается 1 моль CH3 COOH.
1,1 моль кислоты получается из 1,1 моль CaC2 , что составляет 64 1,1 = 70,4 г чистого карбида кальция.
Масса израсходованного технического карбида кальция равна: 70,4 г –– 96%,
x г –– 100 %,
x = 70,4 100 = 73,33 (г) 96

CH2 –OH | CH2 –ONO2 | |||||||||||
3HNO3 | ||||||||||||
CH–ONO2 + 3H2 O | ||||||||||||
CH2 –OH | CH2 –ONO2 | |||||||||||
CH2 –ONO2 | ||||||||||||
CH–ONO2 | 12CO2 | 10H2 O | ||||||||||
поглощается | поглощается | взаимодействует |
||||||||||
CH2 –ONO2 | ||||||||||||
раствором | конц. серной | с медной прово- |
||||||||||
кислотой | ||||||||||||
В мерный цилиндр собирают оставшийся азот.
Из 4 моль нитроглицерина образуется 6 моль азота;
227 4 г | 6 28 г, или 6 22,4 л N2 |
|||||||||||||
x г, или y л N2 , |
||||||||||||||
x = 18,5 г N2 , | y = 14,8 л N2 . |
|||||||||||||
Уравнения реакций: | ||||||||||||||
2 CH3 CH2 CH2 OH | Al 2 O 3 2 CH3 CH=CH2 | |||||||||||||
2 CH3 CHCH3 | CH3 CH–CHCH3 | |||||||||||||
H3 C CH3 | ||||||||||||||
Из 2 моль C3 H7 OH образуется 1 моль C6 H14 : 2 60 г –– 86 г,
x г –– 43 г, x = 60 г.
9. Первоначально азот окисляется до состояния +2, при наличии кислорода в охлажденной смеси образуются соединения азота +4.
Поскольку в конечном растворе не было нитрат-ионов, это значит, что не было и избытка O2 или NO2 в реакции (3).
Это же означает, что в реакции (2) израсходовался весь остаток кислорода, т.е. уравнение (2) можно считать по O2 , а уравнение (3) – по NO2 .
Считаем. Реакция (2): Вошло в реакцию (1 – х) O2 и 2(1 – x) NO, получилось
2(1 – x) NO2 , осталось 2x – 2(1 – x) NO.
Реакция (3): Вошло в реакцию 2(1 – x) NO2 , и 2(1 – x) NO, получилось
2 2(1 – x) CO2 , осталось 2(1 – x) NO.
Результирующая смесь состоит из остатка N2 , остатка NO после реакций (2) + (3) и образовавшегося CO2 :
(1 – x) + + 4(1 – x) = 5/8 2 1 – x + 2x – 2 + 2x – 2 + 2x + 4 – 4x = 1,25
x = 0,25 (25 мольных %).
2.3.2. Расчеты по уравнениям одновременно протекающих реакций.
В практической химической работе достаточно редко расчеты приходится вести только по одной конкретной химической реакции и по одному исходному веществу, масса которого известна. Значительно чаще в реальной лабораторной практике в реакции участвует смесь исходных веществ, каждое из которых вступает в свою химическую реакцию. Возникает задача – на основе суммарной массы образующихся продуктов определить массу одного из компонентов смеси. Поэтому следующий раздел посвящен расчетам на основе химических процессов, включающих в себя несколько параллельных (одновременно протекающих) химических реакций.
Подавляющее большинство задач, которые принято называть «задачами на смеси», включают две параллельные реакции двух исходных веществ (точнее, смеси из двух веществ), идущих с образованием двух продуктов реакции. Представим эти две химические реакции в виде следующих общих схем:
гдеA, B, C, D, E, F, G, H – формулы химических веществ,
a, b, c, d, e, f, g, h – соответствующие стехиометрические коэффициенты в уравнениях (1) и (2).
Из условия задачи известны масса исходной смеси веществ A и E (обозначим ее m1 ) и масса продуктов реакции веществ C и G (обозначим ее m2 ). Требуется определить массу одного из компонентов исходной смеси (например, веществаA).
Решать задачу, как обычно, можно и в граммах, и в молях.
Разберем общее решение задачи, когда масса выражена в граммах. Запишем молекулярные массы всех необходимых для решения задачи веществ как M(A), M(E), M(C), и M(G). Далее выразим одну из масс смесей, например m2 , через m1 и массу искомого компонента m(A), т.е. составим уравнение m2 = f(m1, m(A)).
Получим значение m(C) через m(A) согласно уравнению (1) из пропорции m(A) –– m(C)
aM(A) –– c M(C);
m(C) = cM(C)m(A) aM(A)
аналогично из уравнения (2) получим выражение для m(G):
Получим уравнение (3) с одним неизвестным m(A): bM(B)cM(C)m(A)+aM(A)dM(D) = aM(A)bM(B)m2 ; bM(B)cM(C)m(A)+aM(A)dM(D)m1 aM(A)dM(D)m(A) = aM(A)bM(B)m2 ;
aM(A) | ||||
bM(B)cM(C)- aM(A)dM(D) |
Вычисления упрощаются, когда количественные данные выражены в молях; рассмотрим решение такой задачи также в общем виде. Суть решения сводится к тому, что, обозначив количества веществ A и E через «x» и «y» моль соответственно, необходимо составить два уравнения с двумя неизвестными, выразив m1 = f(x, y) из условия, а m2 = f(x, y) по уравнениям реакций.
В первом уравнении отражается условие задачи: массаA= xM(A), масса E = yM(E), их сумма – m1 , т. е.
xM(A) = yM(E) + m1 |
Во втором уравнении необходимо выразить количества C и соответственно «x» и «y» по уравнению (1):
из a мольAобразуется c моль C, из x мольAобразуется cx/a моль C,
По уравнению (2):
из e моль E образуется g моль G, из y моль E образуется gy/e моль G.
Такимобразом,извыведенныхсоотношенийимеем,чтовеществаCполучено cx/a моль, или cxM(C)/a г, а вещества G получено gy/e моль, или gyM(G)/e г. В сумме получим m2 :

Выведенные уравнения (5) и (6) представляют собой систему, которая обычно решается значительно быстрее, чем ранее выведенное уравнение (3), и дают результат, аналогичный (4). Следует отметить, что в любом случае решение задачи в молях предпочтительнее решения задачи в граммах. Кроме того, на практике чаще всего встречаются задачи, когда вещества C и G (см. уравнения (1) и (2)) представляют собой одно и то же вещество (например, газ либо осадок).
Рассмотрим примеры конкретных химических задач и их решения в граммах и молях.
Пример1. Амальгаму натрия и алюминия массой 5,48 г обработали избытком солянойкислоты.Приэтомвыделилось1,12лводорода(н.у.).Нерастворенное вещество отделили от раствора и взвесили. Его масса составила 4,02 г. Определить массовый состав амальгамы (в процентах).
а. Решение (в граммах). | |
2Na + 2HCl = 2NaCl + H2 | |
2Al + 6HCl = 2AlCl3 + 3H2 | |
Остаток ртуть (4,02 г). |
Масса натрия и алюминия составляет 5,48 – 4,02 = 1,46 (г). Пусть амальгама содержит x г натрия и (1,46 – x) г алюминия.
Тогда в реакции (1) выделяется: 2 22,4 23 x л H2 , а в реакции (2)
3 22,4 (1,46- x) л H 2
Всего 1,12 л H2 . Запишем общее уравнение:22,4 46 x+ 3 2 22,4 27 (1,46- x)=1,12;
46 x +54 3 (1, 46 - x)=0,05;
б. Решение (в молях).
Пусть было x моль Na, y моль Al, или 23 x г Na, 27 y г Al. Учитывая, что сум-
марная масса натрия и алюминия равна 1,46 г (5,48 г амальгамы – 4,02 г Hg), запишем общее уравнение:
23x + 27y = 1,46 (г).
По уравнению (1)
2 моль натрия дают 1 моль водорода,
x моль дают x/2 моль H2 , или 11,2x л H2 . По уравнению (2)
2 мольAl дают 3 моль H2 ,
y мольAl – 1,5 моль H2 или 33,6y л H2 .
Суммарно водорода выделилось 1,12 л, таким образом, 11,2x + 33,6y = 1,12 (л).
Теперь имеем систему двух уравнений с двумя неизвестными:
23x + 27y = 1,46 | 23x + 27y = 1,46 |
|
11,2x + 33,6y = 1,12 |
отсюда x = 0,04 моль, или 0,92 г Na; y = 0,02 моль, или 0,54 гAl;
Пример 2. Смесь цинка и безводного нитрата цинка прокалили на воздухе, ее масса при этом не изменилась. Определите массовые доли компонентов смеси.
Решение. При прокаливании происходят реакции:
2Zn + O2 =t o 2ZnO;
2Zn(NO3 )2 =t o 2ZnO + 4NO2 + O2
M(Zn) = 65; M(ZnO) = 81; M(Zn(NO3 )2 ) = 189.
Пусть масса цинка в смеси – m1 , а масса нитрата цинка – m2 . При окислении Zn образуется (81/65)m1 г ZnO. При разложении нитрата получается (81/189)m2 г ZnO. По условию задачи масса смеси после прокаливания не изменяется, следовательно:
1,24m1 + 0,43m2 = m1 + m2 , откуда m1 = 2,37m2 .
Таким образом, массовая доля нитрата цинка в смеси равна:
Пример 3. 11,32 г смеси перманганата калия и мела растворили в избытке соляной кислоты, при этом выделилось 3,36 л газообразных веществ. Определите массовые доли компонентов исходной смеси. Напишите уравнения химических реакций. (Обьем газообразных веществ приведен к н.у.).
Уравнения химических реакций:
2KMnO4 + 16HCl = 2MnCl2 + 2KCl + 5Cl2 + 8H2 O, CaCO3 + 2HCl = CaCl2 + H2 O + CO2 ;
M(KMnO4 ) = 158; M(CaCO3 ) = 100.
Примем количество KMnO4 за x моль, а СaCO3 – за y моль. Тогда масса ис-
ходной смеси: 158x + 100y = 11,32 (г).
Объем выделившегося хлора: 5/2 22,4x (л). Объем выделившегося CO2 – 22,4y (л).
Сумма: 5/2 22,4x + 22,4y = 3,36.
Получим систему уравнений с двумя неизвестными:
{ 158x +100y = 11,32; 5/2.22,4x + 22,4y = 3,36;
{ 158x – 250x + 15 = 11,32,
2,5x + y = 0,15,
Откуда x = 0,04; y = 0,05.
Масса KMnO4 равна 158 0,04 = 6,32 (г); масса CaCO3 равна 100 0,05 = 5,0 (г) (сумма, по условию, 11,32 г).
w (KMnO4 ) = 6,32/11,32 100 = 55,83%;w (CaCO3 ) = 5,0/11,32 100 = 44,16%.
Пример 4. Водный раствор 3,88 г смеси муравьиного и уксусного альдегидов обработали избытком аммиачного раствора оксида серебра. Выпавший при этом осадок отфильтровали, промыли водой и полностью растворили в концентрированной азотной кислоте. При этом выделилось 9,856 л газа (н.у.). Определить процентный состав исходной смеси.
Ag + 2HNO3 =AgNO3 + NO2 + H2 O
Газа выделилось 9,856/22,4 = 0,44 моль. Значит, серебра было также 0,44 моль. Пусть в исходной смеси x (г) H2 C=O и (3,88–x) (г) CH3 CHO,
или x/30 (моль) H2 C=O и (3,88–x)/44 (моль) CH3 CHO.
Реакции окисления этих альдегидов отличаются друг от друга; промежуточно образующаяся из муравьиного альдегида муравьиная кислота окисляется дальше – до CO2 , который с NH3 образует соль; а окисление уксусного альдегида останавливается на кислоте:
H2 C=O + 4OH = 4Ag+ (NH4 )2 CO3 + 6NH3 + 2H2 O; CH3 CH=O + 2OH = 2Ag+ CH3 COONH4 + 3NH3 + 2H2 O.
Рассчитаем количество серебра по каждой из реакций и просуммируем:
30 x2 + 3,88 44 - x = 0,44 2
x = 3,00 г H2 C=O, тогда CH3 CH=O: (3,88 – 3) = 0,88 г.
Таким образом, количество муравьиного и уксусного альдегида в смеси – 0,1 и 0,02 моль соответственно, что составляет 77,3 и 22,7 % по массе, или 83,3 и 16,7 мольных %, cоответственно.
Пример 5. Смесь метана с кислородом объемом 1,00 л подожжена электическим разрядом. В результате реакции сгорания выделилось 8,22 кДж теплоты. Продукты взаимодействия пропущены через раствор щелочи, при этом 0,40 л газа осталось непоглощенным (объемы газов измерены при н. у.). Вычислите объемные доли метана и кислорода в исходной смеси, если известно, что теплоты образования метана, паров воды, оксида углерода(IV) и оксида углерода(II) равны соответственно 75, 242, 394 и 110 кДж/моль. Какие дополнительные ограничения следовало бы ввести в условия для более строгого решения задачи? Ответ мотивируйте.
Решение. Сгорание метана в избытке кислорода происходит с образованием СО2 и паров воды по уравнению:
СН4 + 2O2 = СO2 + 2Н2 O + Q1 |
Если бы оставшийся непоглощенным после реакции газ был кислородом, а СО2 и пары воды поглотились раствором щелочи, то по уравнению (1) должно было прореагировать 0,6 л смеси СН4 + 2O2 в соотношении 1:2. Полученное в этом случае содержание в смеси 0,2 л метана (20% по объему) должно согласовываться с термохимическими данными. Тепловой эффект реакции (1) равен
Q1 = QобpCO 2 + 2Qoбp.Н 2 O – Qoбр.CH 4 = 394 + 2. 242 – 75 = 803 (кДж/моль),
и при сгорании 0,2 л метана выделилось бы
Q = 0,2 . 803/22,4 = 7,12 кДж,
что не согласуется с условиями задачи.
Следовательно, оставшийся непоглощенным газ не может быть кислородом. При недостатке кислорода сгорание метана может приводить к образованию оксида углерода(II) и паров воды по уравнению:
СН4 + 1,5O2 = СО + 2Н2 O + Q2 |
Предположение о том, что оставшийся непоглощенным газ является СО (0,4 л СО образовались при реакции 0,4 л СН4 и 0,6 л O2 – сумма объемов совпадает с объемом смеси) также должно быть подтверждено термохимическим рас-
четом. Тепловой эффект реакции (2):
Q2 = Qo6p.CO + 2Qo6p.H 2 O – Qo6p.CH 4 = 110 + 2. 242 – 75 = 519 (кДж/моль).
При сгорании 0,4 л метана должно было выделиться
Q = 519. 0,4/22,4 = 9,23 (кДж),
что также не согласуется с данными задачи.
Можно предположить, что кислорода в исходной смеси было недостаточно для полного сгорания метана, и что не поглощенный раствором щелочи газ представляет собой смесь метана и СО, т. е. реакция одновременно протекала по уравнениям (1) и (2), и к тому же часть метана не сгорела.
Расчеты в данном случае удобнее провести не на 1 л, а на 1 моль газовой смеси, пересчитав тепловой эффект сгорания 1 л на объем моля – 22,4 л:
Q = 8,22. 22,4 = 184,2 (кДж) на моль смеси.
Составим систему алгебраических уравнений: пусть по уравнению (1) прореагировало х моль СН4 с 2х моль O2 и выделилось 803х кДж теплоты. По уравнению (2) прореагировало у моль СН4 с 1,5у моль O2 , выделив 519у кДж теплоты и образовав у моль СО. При этом а моль метана не вступило в реакцию. В смеси было b моль O2 , которые прореагировали полностью (b = 2х + 1,5у). Для 1 моль газовой смеси получаем систему четырех уравнений с четырьмя неизвестными:
х + у + а + и = 1 – число моль всех газов в исходной смеси
2х +1,5у = b – количество кислорода, вступившего в реакцию. 803х + 519у = 184,2 – количество теплоты, выделившейся при р-циях. а + у = 0,4 – число молей образовавшегося СО и непрореагировавшего метана (непоглощенный раствором щелочи газ).
Решение этой системы уравнений с исключением а, х, у дает b = 0,5, т. е. мольная (и объемная) доля СН4 в смеси составляет 50 %.
Для более строгого решения задачи следует оговорить, что рассматривается протекание реакций только по двум направлениям, что потерями тепла и наличием паров воды можно пренебречь, а также заменить нормальные условия на стандартные (или пересчитать тепловые эффекты на объемы при 25 °С).
1. При сжигании образца каменного угля массой 1 г получилось 0,25 г золы, 0,18 воды и 2,62 г смеси углекислого и сернистого газов. Сколько процентов серы содержал образец? Сколько сернистого газа в год выделяется при работе тепловой электростанции, потребляющей 1 млн. т такого угля в год?
2. Привзаимодействии6,05гсмесипорошковжелезаицинкасизбытком раствора хлорида меди(II) образуется 6,4 г металлической меди. Определите состав смеси.
3. Смесь двух веществ нагрели в токе оксида углерода(II). При этом образовалось два летучих продукта, один из которых можно сконденсировать при охлаждении льдом в светлую, разлагающуюся на воздухе жидкость. Для определения состава ее запаяли в вакууме в две предварительно взвешенные ампулы объемом 1,00 мл каждая (разность результатов взвешиваний 1,63 мг и 4,45 мг соответственно), затем каждую ампулу поместили в отдельные сосуды, содержащие избыток кислорода, разбили, а содержимое сожгли. После приведения системы к исходным условиям (1 атм, 25 °С) оказалось, что объемы газов в сосудах возросли на 0,604 мл и 1,208 мл соответственно. В составе продуктов обнаружено лишь два вещества: А (1,23 мг в первом сосуде и 2,46 во втором) и Б, которое реагирует с баритовой водой с образованием белого осадка.. Известно также, что 1,23 мг А способны прореагировать с 0,400 мл водорода (1 атм, 25 °С). Определите возможный состав исходной смеси. Объемом стенок ампулы можно пренебречь.
4. Смесь ацетилена и водорода массой 27 г сожгли в кислороде. После охлаждения продуктов сгорания до комнатной температуры сконденсировалось 27 мл воды. Определите состав газовой смеси.
5. Смесь равных по массе количеств цинка и карбоната кальция обработали избытком раствора соляной кислоты. Расcчитайте среднюю плотность ρ образующейся смеси газов (г/л).
6. При термическом разложении (150 – 180 o C) 100,0 г смеси нитрата и нитрита аммония выделилось 47,69 г газообразных продуктов (н.у.). Определите состав смеси.
7. Для полного восстановления 200 мл смеси оксида азота(I) и оксида азота(IV) до азота было использовано 300 мл водорода. После окончания реакции, конденсации паров воды и приведения смеси к начальным условиям общий объем составил 225 мл. Определите состав взятой смеси.
8. К смеси азота, водорода и метана объемом 130 мл добавили 200 мл кислорода, а затем смесь подожгли. После окончания горения и конденсации паров воды общий объем полученной смеси газов составил 114 мл при тех же условиях, а после пропускания продуктов сгорания через избыток раствора щелочи объем уменьшился до 72 мл. Найти исходные объемы азота, водорода и метана.
9. Сплав состоит из рубидия и еще одного щелочного металла. При взаимодействии 4,6 г сплава с водой получено 2,241 л водорода (н.у.). Какой металл является вторым компонентом сплава? Каковы массовые доли (%) компонентов сплава?
10. Над смесью металла с его оксидом пропустили водород до полного восстановления оксида, а продукт реакции растворили в разбавленной серной кислоте. Объем выделившегося при этом водорода равен объему водорода, пошедшего на восстановление исходной смеси (объемы измерены при одинаковых условиях). Какие металлы и оксиды удовлетворяют условию задачи? Приведите примеры таких смесей, рассчитайте в этих примерах молярные соотношения металла и его оксида.
11. Образец, содержащий хлориды натрия и калия, имеет массу 25 г. К
водному раствору образца прибавили 840 мл раствора AgNO3 (0,5 моль/л). Осадок отфильтровали, после чего опустили в раствор медную пластинку массой 100,00 г. Через некоторое время масса пластинки составила 101,52 г. Рассчитайте массовые доли компонентов исходной смеси.
12. При прокаливании смеси безводных солей гидрокарбоната и карбоната натрия до постоянной массы выделяется газ, объем которого составляет 60% объема газа, выделяющегося при действии соляной кислоты на полученный остаток. Вычислите молярное соотношение солей в исходной смеси.
13. Смесь нитратов натрия и серебра прокалили, а выделившиеся газы пропустили в воду. При этом объем газов уменьшился в 3 раза. Определите массовый состав исходной смеси.
14. Предполагают, что смесь металлических опилок содержит магний, алюминий и олово. При растворении 0,75 г опилок в соляной кислоте выделилось 0,784 л водорода (н.у.). При сжигании такой же навески в токе кислорода образовалось 1,31 г оксидов. Установите процентный состав исходной смеси.
15. Магний массой 19,2 г сожгли на воздухе. Для растворения полученного вещества понадобилось 320,7 г 20,5%-го раствора HCl. Раствор выпарили и осадок прокалили, конденсируя летучие вещества. Определите качественный состав конденсата.
16. Через 22,4 л смеси водорода, кислорода и хлора (н.у.) пропустили электрический разряд. После охлаждения продуктов реакции в сосуде обнаружили газ и жидкость. На нейтрализацию жидкости пошло 1,6 г гидроксида натрия. Оставшийся в сосуде после реакции газ полностью прореагировал с нагретым оксидом меди (II), причем масса последнего уменьшилась на 0,96 г. Определите объемные доли газов, составляющих исходную смесь.
17. Смесь газообразных хлора и хлороводорода объемом 22,4 л пропустили над нагретыми железными опилками. Масса опилок увеличилась при этом на 42,6 г. Определите состав исходной смеси.
18. Имеется сплав двух металлов, взятых в молярном соотношении 1:1. Прирастворениивизбыткесолянойкислотынавескисплавамассой1,02гили при обработке 1,7 г сплава избытком нагретого раствора NaOH получается один и тот же объем водорода (1120 мл). Из каких металлов состоит сплав, каков его процентный состав? Что можно сказать о химических свойствах этих металлов, исходя из положения в Периодической системе Д.И. Менделеева?
19. Смесь хлоридов магния, железа (III) и меди (II) растворили в воде. Масса осадка, образовавшегося при добавлении избытка сульфида натрия к этому раствору, в 2,51 раза больше, чем при в него пропускании избытка сероводорода. Если в растворе заменить хлорид железа (III) на хлорид железа (II), отношение масс осадков станет равно 3,36. Определите состав смеси хлоридов в массовых долях. Напишите уравнения химических реакций, протекающих в растворах хлоридов при действии на них сульфида натрия и сероводорода.
20. Смесь кальция и алюминия массой 18,8 г прокалили без доступа воздухасизбыткомпорошкаграфита;продуктреакцииобработалиразбавленной соляной кислотой, при этом выделилось 11,2 л газа. Определите состав смеси.
21. Смесь порошков магния и железа массой 6,24 г разделили на две равные части. Одну часть сожгли в кислороде и получили 4,72 г продуктов сгорания. Вторую сожгли на воздухе и к продуктам сгорания (их масса оказалась равной 4.52 г) прилили раствор гидроксида натрия. Какой газ и в каком объеме выделился при этом? Приведите уравнения химических реакций.
22. Смесь метана и ацетилена объемом 20 мл сожгли в избытке кислоро-
да, при этом образовалось 32 мл CO2 . Определите состав исходной смеси в объемных долях.
23. К раствору 13,95 г смеси свежеполученных хлорида и бромида хрома (II) прибавили избыток раствора нитрата серебра. Выпавший осадок имел массу 32,99 г. Определите количественный состав исходной смеси.
24. При внесении в избыток воды 10 г сплава рубидия с цинком выделилось 1,12 л газа (в пересчете на нормальные условия). Определите состав сплава в процентах по массе.
25. При полном разложении при высокой температуре 54 г нитрита, нитрата и бихромата аммония получено 15,2 г твердого остатка. При этом выделилось 11,2 л газа (н.у.). Определить массы компонентов исходной смеси.
26. При окислении 38 г смеси бензола, стирола и изопропилбензола под-
кисленным раствором перманганата калия образовалось 24,4 г бензойной
кислоты и выделилось 6,72 л углекислого газа. Определите количественный состав смеси.
27. Смесь, состоящая из пропадиена, пропена, пентадиена-1,4, 1-ви- нилциклопентена-1, при исчерпывающем каталитическом гидрировании поглощает объем водорода, равный половине объема углекислого газа (н.у.), образующегося при сжигании такого же количества смеси. Определить объемное содержание пропадиена в парах этой смеси.
28. При полном сгорании 2,72 г смеси двух гомологов предельных углеводородов, отличающихся по своему составу на два атома углерода, было получено 8,36 г диоксида углерода. Какие углеводороды и в каких количествах были смешаны? Можно ли найти общий метод решения подобной задачи для смесей двух гомологов, отличающихся на k атомов углерода?
29. Смесь двух твердых простых веществ массой 1,52 г обработали избытком соляной кислоты. В результате реакции выделилось 0,896 л газа и осталось 0,56 г нерастворенного вещества.
Такую же навеску смеси обработали избытком 10%-ного раствора NaOH. В этом случае также выделилось 0,896 л газа, а масса твердого остатка составила 0,96 г.
В третьем эксперименте такую же навеску смеси црокаливали в отсутствие воздуха. Получено вещество, полностью растворимое в соляной кислоте с выделением 0,448 л неизвестного газа. Газ собрали и поместили в однолитровый закрытый сосуд, наполненный кислородом. После взаимодействия неизвестного газа с кислородом давление в сосуде уменьшилось приблизитель¬но в 10 раз.
Напишите уравнения описанных реакций и подтвердите их правильность соответствующими расчетами. При решении задачи считайте, что объемы газов измерены при н.у., и округляйте значения относительных атомных масс до целых чисел.
1. Негорючих примесей и водорода в 1 г угля содержится: 0,25 + 0,02 = 0,27 г; серы и углерода 1–0,27 = 0,73 г.
Если углерода x г, то серы (0,73–x) г.
C + O2 = CO2 ; S + O2 = SO2 .
Составим уравнение:
12 44 x+ 64 32 (0,73- x) = 2,62
x = 0,70 г углерода и 0,03 г (3%) серы.
При сжигании 1 млн. т угля сгорает 10000000,03 = 30000 т серы и образуется
(64/32)30000 = 60000 т сернистого газа в год.
2. Уравнения реакций:
Fe + CuCl2 = Cu + FeCl2
Zn + CuCl2 | Cu + ZnCl2 |
|
Ar (Fe) = 56;Ar (Zn) = 65;Ar (Cu) = 64.
Из уравнений реакций имеем:
x моль Fe образует x моль Cu y моль Zn образует x моль Cu
Поскольку масса смеси порошков железа и цинка, вступивших в реакцию, равна 6,05 г, то можно записать первое уравнение:
56x + 65y = 6,05
В результате двух реакций образуется (x+y) моль меди, или 64(x+y) = 6,4 г. Получили систему уравнений:
{ 56x + 65y = 6,05 64(x+y) = 6,4
решая которую получаем:
x = 0,05 моль и y = 0,05 моль, или 2,8 г Fe и 3,25 г Zn.
3. Исходя из относительных количеств А и Н2 , вступающих в реакцию, определим эквивалент А: 37,6. Это близко к эквиваленту хлора (валентность 1) или никеля (валентность 2) в его соединении с кислородом. Возможный вариант также – оксид олова (IV). Очевидно, Б - углекислый газ, дающий с баритовой водой белый осадок карбоната бария.
Таким образом, летучая жидкость – углеродсодержащее соединение хлора, никеля или олова, обладающее высокой летучестью. Судя по методу его получения, оно может также включать в свой состав и кислород.
Возможная ошибка при решении задачи – неучет массы воздуха, т.е. архимедовой силы, действующей на ампулу с жидкостью при взвешивании. Необходимо учесть эту силу, действующую на тело объемом 1,00 мл в воздухе сплотностью29. 273/(298. 22400)=1,186мг/млпри25°Сиравную1,63+1,186 = 2,816 мг. O необходимости учета этой силы свидетельствует и отношение навесок жидкости (не равное 2), при сжигании которых образуются одни и те же продукты в соотношении 1:2.
Запишем формулу жидкости в виде Э(CO)n , где п - некоторое целое число. Ecли Э – хлор, выделившийся после сжигания навески в виде газа, то n может
быть равно и 0,5.
Уравнение реакции сжигания жидкости
2Э(СO)n +nO2 = Э2 + 2nСO2
для этого случая приводит к следующим соотношениям:
х(Э + 28n) = 2,816 и
(n + 1)х/2 = 0,604. 273/(298. 22,4);
здесь х - число миллиграмм-эквивалентов вещества Э.
Первый вариант, когда при окислении жидкости получается Э2 – газ, соответствует одному из трех возможных Э – хлору. Подстановка Э = 35,5 в эти уравнения приводит к отрицательным n, что абсурдно.
Другой вариант соответствует твердому веществу А – оксиду. Тогда уравнения следует записать в виде:
Э2 (СO)2n + (n + 0,5)O2 = Э2 O + 2nCO2
х(Э +28n) = 2,816 и (n – 0,5). 0,5х = 0,604. 273/(298. 22,4).
Отсюда Э + 28,5 = 29n. Подставляя возможные значения Э, равные 29,5 (никель, А – оксид никеля NiO) и (олово, А – оксид олова SnO2 ), получаем n = 2 и формулы для летучей жидкости: Ni(CO)4 и Sn(CO)8 .
Октакарбонила олова не существует, поэтому единственный вариант, отвечающий условиям задачи – тетракарбонил никеля. Смесь, из которой получается летучий тетракарбонил, должна содержать либо металлический никель в смеси с веществом – источником второго неконденсируемого летучего продукта, например СO2 , либо один из оксидов никеля в смеси с инертным веществом. В этом случае газовая смесь также содержала бы смесь паров тетракарбонила никеля и СO2 .
Итак, возможны 2 варианта исходной смеси: никель и некоторый оксид (металла) или оксид никеля с инертной примесью.
Уравнения реакций:
Ni + 4СО = Ni(CO)4
МО + СО = М + СO2 .
4. Уравнения реакций: 2H 2 + O2 = 2H2 O;
2C2 H2 + 5O2 = 4CO2 + 2H2 O.
Пусть в смеси было x моль водорода и y моль ацетилена. Тогда масса исходной смеси:
2x + 26y = 27 (первое уравнение системы).
По уравнениям реакций: из x моль H2 получаем x моль H2 O, из yмоль C2 H2 – y моль H2 O. Суммируя, получаем второе уравнение системы:
{ 18x+18y = 27 | { 2x+2y = 3 |
x = 0,5 моль H2 , y = 1,0 моль C2 H2 .
5. Пусть цинка было x моль, карбоната кальция – y моль, массы соответственно равны 65x и 100y. По условию 65x=100y, y=0,65x.
Получается водорода x моль, или 2x г; CO2 – y моль, или 44y г. Zn + 2HCl = ZnCl2 + H2 ;
CaCO3 + 2HCl = CaCl2 + CO2 + H2 O.
Масса полученной смеси газов: (2x + 44y) г; объем: 22,4(x + y) л; Средняя плотность:
Подставляя y = 0,65x, получим
ρ = | 2x + 44 0,65x | |||||
22,4(x + 0,65x) | ||||||
6. Для решения задачи необходимо:
a. Записать уравнения разложения NH 4 NO3 и NH4 NO2 : NH4 NO3 = N2 O + 2H2 O
NH4 NO2 = N2 + 2H2 O
b. Составить систему из двух уравнений:
m(NH4 NO3 ) + m(NH4 NO2 ) = 100.0
m(NH4 NO3 )M(N2 O)/M(NH4 NO3 ) + m(NH4 NO2 )M(N2 )/M(NH4 NO2 ) = 47.69
c. Решить систему уравнений.
Ответ: m(NH4 NO3 ) = 35.0 г; m(NH4 NO2 ) = 65.0 г.
7. Уравнения реакций: N 2 O + H2 = N2 + H2 O;
2NO2 + 4H2 = N2 + 4H2 O.
Каквидноизуравненийреакций,объемобразовавшегосяазотанеможетбыть больше начального объема смеси оксидов азота, если количество водорода соответствует этим уравнениям. Но, по условиям задачи, конечный объем (225 мл) больше начального (200 мл), что указывает на избыток водорода и полное протекание реакции.
Пусть в исходной смеси было x мл оксида азота (I) и y мл оксида азота (IV). Начальный объем смеси x + y = 200 мл.
Для выражения конечного объема смеси запишем следующие уравнения:
1) Конечная смесь состоит из избыточного водорода и азота. Объем азота равен x+0,5y, что следует из уравнений реакции.
2) Объем прореагировавшего водорода равен x + 2y, а его избыток 300–x–2y, отсюда конечный объем смеси равен
225 = x + 0,5y + 300–x–2y;
y = 50 мл., x = 200–y = 150 мл.
Объем оксида азота (I) – 150 мл, объем оксида азота (IV) – 50 мл.
8. Уравнения реакций
2H2 + O2 | 2H2 O; |
CH4 + 2O2 | CO2 + 2H2 O. |
Согласно уравнениям реакций в результате горения первоначальный объем смеси водорода и метана уменьшается. По условию задачи, начальный объем смеси равен 130 мл, а общий объем после сгорания – 144 мл.
Так как азот не вступает в реакцию и его объем не меняется, прирост объема достигается за счет избыточного кислорода. Следовательно, кислород был в избытке и реакции горения прошли до конца.
V(CO2 ) = V(CH4 ) = 144 – 72 = 72 мл.
Объем смеси | после горения: | ||
– V(H2 ) – 1/2V(H2 ) – | |||
объем O2 , | объем O2 , |
||
объединив- | объединив- |
||
шегося с H2 | шегося с CH4 |
||
Отсюда V(H2 ) = 28 мл, V(N2 ) = 130 – 72 – 28 = 30 мл.
9. Уравнение реакции:
2M + 2H2 O = 2MOH + H2
M – щелочной металл; ν (H2 ) = 0,1 моль;ν (M) = 0,2 моль; средняя молярная масса: Мср = m/ν = 4,6/0,2 = 23 г/моль (соответствует атомной массе натрия). Из чего следует, что вторым компонентом сплава может быть только щелочный металл с относительной массой меньше 23, это-литий; сплав состоит из рубидия и лития.
ν (Rb) +ν (Li) = 0,2 (моль);
m(Rb) + m(Li) = 4.6 (г);
ν (Rb)M (Rb)+ ν (Li)M (Li)= 4.6; ν (Rb)M (Rb)+ (0,2– ν (Rb))M (Li) = 4.6;
ν (Rb) 85,5 + (0,2–ν (Rb) )7 = 4.6;
ν (Rb) = 0,0408 (моль);ν (Li) = 0,1592 (моль).
Таким образом, состав смеси:
216 , y = 0,63, x = 2,15 (г)Ag+. 1,52 + y
w (Rb) = 0,0408 85,5 100 ≈ 76% 4,6
w (Li) = 0,1592 7 100 ≈ 24% 4,6
10. А (Cu) =63,5, A(Ag) =108,
Cu + 2AgNO3 = Cu(NO3 )2 + 2Ag
Пусть x – масса осажденного серебра, y – масса растворенной меди. 65,3/y = 2,108/x
x–y = 101,52 – 100,00 = 1,52 x = 1,52 + y
65,3 y
Масса нитрата серебра: (840/1000) 0,5170=71,4 гAgNO3 ,
Пусть z - масса NaCl в смеси, k - масса KCl в смеси; z г NaCl содержит 35,5/58,5x Cl–;
k г KCl –– 35,5/74,6x Cl–;
35,5z 58,5 + 35,5k 74,6 = 14,2 z + k = 25
Откуда z=17,6 г NaCl, или 70,2%; k=7,4 г KCl, или 29,8%.
9. Смесь должна удовлетворять следующим условиям:
а) металл должен реагировать с разбавленной серной кислотой, а его оксид – полностью восстанавливаться водородом;
б) металл в оксиде должен иметь бoльшую положительную степень окисления, чем в сульфате, полученном при реакции металла с H2 SO4 .
Примеры смесей: 1) Sn и SnO2
SnO2 +2H2 = Sn+2H2 O,
Sn+H2 SO4 = SnSO4 +H2 .
Молярное соотношение 1:1.
2) Fe и Fe2 O3
Fe2 O3 +3H2 = 2Fe+3H2 O,
Fe+H2 SO4 = FeSO4 +H2 .
1мольFe2 O3 привосстановленииобразует2мольFe,прирастворениикоторых в H2 SO4 образуется 2 моль H2 . 1 моль Fe при растворении в H2 SO4 образует 1 моль водорода. Всего образуется 3 моль H2 . Следовательно, молярное отношение металла и оксида в смеси 1:1.
3) Fe и Fe3 O4
Fe3 O4 +4H2 = 3Fe+4H2 O,
Fe+H2 SO4 = FeSO4 +H2 .
1 моль Fe3 O4 образует 3 моль Fe, 3 моль Fe восстанавливают 3 моль H2 из H2 SO4 , поэтому молярное отношение металла и оксида в смеси - 1:1.
11. A– NH3 , Б – NО2 ,
В и Г – NH4 NO2 и NH4 NO3 , 2NH3 +2NO2 +H2 O = NH4 NO2 +NH4 NO3 ,
Д, Е – N2 , N2 O
NH4 NO2/ NH4 NO3 = N2 +N2 O+4H2 O,
(to ,P) эл.дуга
N2 +3H2 = 2NH3 , N2 +O2 $ 2NO,
комн.т-ра:
2NО+О2 = 2NО2 .
12. Прокаливание:
2NaHCO3 = Na2 CO3 + H2 O + CO2
Обработка остатка HQ:
Na2 CO3 + 2HCl = 2NaCl + H20 + CO2
Пусть в смеси на 1 моль NaHCO3 приходится х моль Na2 CO3 . При прокаливании из 1 моль NaHCO3 образуется 0,5 моль CO2 , а в остатке содержится
(0,5 + х) моль Na2 CO3 .
По условию: V1 (CO2 ) = 0.6V2 (CO2 ); т.е. n1 (CO2 ) = 0.6 n2 (CO2 ); 0,5 = 0,6 (0,5 + х); отсюда х = 0,333.
Молярное соотношение NaHCO3 и Na2 CO3 в исходной смеси составит: n(NaHCO3 ) : n(Na2 CO3 ) = 1: 0,333 = 3: 1
13. Уравнения реакций:
2AgNO3 = 2Ag + 2NO2 | O2 |
||
2NaNO3 = 2NaNO2 | O2 |
|
При пропускании NO2 и O2 в воду оксид азота (IV) поглощается полностью (так как кислород, согласно уравнениям реакции, в избытке):
4NO2 + O2 + 2H2 O = 4HNO3 ν: x x/4
Первоначально было (x+x/2+y/2) моль газа, затем (x+x/4) моль поглотилось.
Отсюда x+x/4 = 2/3(x+x/2+y/2), или y = 3/4x.
Итак, в смеси было 170 x гAgNO3 | и 85 3/4x = 63,75x г NaNO3 , |
|
что составляет 72,72%AgNO3 и 27,28% NaNO3 . |
||
Пусть в смеси x г магния, y г алюминия и z г олова (или, соответствен- |
||
но, x/24, y/27 и z/118,7 моль каждого металла). |
||
Mg + 2HCl = MgCl2 + H2 ; | Mg + 1/2O2 = MgO; |
|
Al + 3HCl =AlCl3 + 3/2H2 ; | 2Al + 3/2O2 =Al2 O3 ; |
|
Sn + 2HCl = SnCl2 + H2 ; | Sn + O2 = SnO2 . |
|
Из уравнений следует:
1 моль магния вытесняет 22,4 л водорода,
x/24 моль магния вытесняет (x/24) 22,4/1 л водорода. Аналогично для алюминия и олова, а также для реакций окисления:
1 моль магния образует 40 г оксида,
x/24 моль магния образует (x/25) 40/1 г оксида. Запишем систему уравнений:
{ x + y + z = 0,75
x/24 22,4 + y/27 1,5 22,4 + z/118,7 22,4 = 0,784 x/24 40 + y/27 51 + z/118,7 150,7 = 1,31
Решая эту систему, получаем x = 0,48 г магния, y = 0,27 г алюминия, олово в смеси отсутствует (z=0).
15. Оксид магния растворяется в кислоте: MgO + 2HCl = MgCl 2 + H2 O;
при этом использовали 320,7 0,205 = 65,74 г HCl, или 1,80 моль. Для растворения 19,2/24 = 0,8 моль магния требуется 1,60 моль соляной кислоты. Поскольку кислоты оказалось на 0,20 моль больше, то в продуктах горения должно быть еще какое-либо соединение, содержащее магний. Таким соединением, по-видимому, может быть нитрид магния Mg3 N2 , образующийся наряду с оксидом при горении магния на воздухе:
2Mg + O2 = 2MgO; 3Mg + N2 = Mg3 N2 .
При растворении нитрида в кислоте: Mg3 N2 + 8HCl = 3MgCl2 + 2NH4 Cl.
При прокаливании продуктов будет идти реакция: 2MgCl2 + H2 O = (MgCl)2 O + 2HCl.
В конденсате присутствуют NH4 Cl; HCl и H2 O.
16. Уравнения реакций:
H2 + Cl2 = 2HCl; 2H2 + O2 = 2H2 O; HCl + NaOH = NaCl + H2 O
На нейтрализацию HCl пошло 1,6 г NaOH, что составляет 0,04 моль. Следовательно, ν (HCl) = 0,04 моль. На образование HCl пошло по 0,02 моль H2 и Cl2 . С оксидом меди прореагировал избыток H2 :
CuO + H2 = Cu + H2 O 1 моль –– 16 г O,
x моль –– 0,96 г, x=0,06 моль водорода.
На образование воды пошло 1–(0,06+0,02+0,02)=0,9 моль газов, из них: 0,6 моль H2 и 0,3 моль O2 .
Таким образом, состав смеси (л):
Cl2 – 0,448 (2%); O2 – 6.72 (30%); H2 – 15.232 (68%).
Обозначим через x моль – количество хлора, (1–x) моль – количество HCl в смеси. Тогда 71 x г – масса хлора, а 36,5(1–x) г масса хлороводорода. Так как масса железных опилок при прокаливании в смеси хлора и хлороводорода увеличилась на 42,6 г, то можно записать следующее соотношение:
71x + 36,5(1–x) – (1–x) = 42,6.
Отсюда x = 0,2 моль хлора (4,48 л), а хлороводорода было 1–x=0,8 моль (17.92 л). Поскольку в избытке в смеси хлороводород (а не хлор), то реакция (3) не идет.
18. Исходя из условия задачи, можно прийти к выводу, что с кислотой реагируют оба металла, а со щелочью – один, т.е. один из металлов, образующих сплав, амфотерный.
1-й вариант решения.
Для решения задачи следует определить понятие эквивалента. Эквивалентом химического элемента называют такое его количество, которое соединяется с 1 моль атомов водорода или замещает то же количество атомов водорода в химических реакциях. 1120 мл соответствует 0,1 моль атомов водорода. Таким образом, в 1,7 г сплава содержится 0,1 эквивалента амфотерного металла, а в 1,02 г содержится в сумме 0,1 эквивалента обоих металлов, т.е. 1,02/1,7=0,06 эквивалента амфотерного металла и, соответственно, 0,04 эквивалента другого металла. Учитывая это, а также то, что металлы в сплаве содержатся в эквимолярном соотношении, получаем, что валентности металлов относятся как 2:3, причем амфотерный металл – трехвалентный. В итоге приходим к уравнению 0,06x + 0,04y = 1,02, где x и y – значения эквивалентов, или
3x + 2y = 51, причем 3x = A(M1) ; 2y = A(M2) , т.е. сумма атомных масс металлов равна 51. Из Периодической таблицы находим, что это алюминий и магний.
2-й вариант решения:
Объем Н2 , выделяемого вторым металлом из кислоты: 1120. 1,02/1,7 = 672 мл,
следовательно, первым: 1120 – 672 = 448 мл.
Отношение валентностей V1 (H2 )/V2 (H2 ) = B1 /B2 = 448/672 = 2:3 (малые (1–3)
целые числа). Следовательно, валентности металлов: 2 и 3. Отсюда объем водорода из кислоты, если количества металлов составляли по n моль, равен:
(1 + 2/3). 22400n = 1120, n = 0,02.
(A1 +A2 ). 0,02 = 1,02,
A1 +A2 = 51.
19. При пропускании сероводорода в раствор смеси хлоридов: магния (a моль), железа (III) (b моль) и меди (II) (1–a–b) моль:
MgCl2 + H2 Sне идет;
2FeCl3 + H2 S2FeCl2 + S+ 2HCl; (масса осадка 32b/2 = 16b);
CuCl2 +H2 SCuS+ 2HCl (масса осадка 96–96a–96b).
Общая масса осадка: (96–96a–80b)г.
96+ 8b- 38a | = 2,51 ( | î ñàäî ê Na 2 S | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
96- 96a - 80b | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
î ñàäî ê H 88); CuCl2 + Na2 S$ CuS + 2NaCl (масса осадка 96 – 96a – 96b). Общая масса осадка: (96 – 38a + 16,6b) г 96 - 38a + 16,6b = 3,36 (2) 96- 96a - 96b решаем систему уравнений (1) и (2); a = 0,2 моль MgCl2 ; b = 0,5 моль FeCl2 , c = 0,3 моль CuCl2 Находим состав смеси:
w (CuCl2 ) = 100- 13,50- 57,72 = 28,78% 20. Даже если бы весь газ (11,2 л) состоял из C2 H2 , в нем было бы только 12 г С, следовательно, углерод в избытке. Происходящие реакции:
CaC2 + 2HCl = CaCl2 + C2 H2 Al4 C3 + 12HCl = 4AlCl3 + 3CH4 Стехиометрические схемы: Ca $ CaC2 $ C2 H2 4Al $ Al4 C3 $ 3CH4 , или 4/3Al$ CH4 Выделилось x моль CH4 и (0,5 – x) моль C2 H2 , которые образовались из (1/3)x мольAl4 C3 и (0,5 – x) моль CaC2 , соответственно; эти количества карбида получены из (4/3)x мольAl и (0,5 – x) моль Ca, соотвественно. (4/3)x 27 + (0,5 – x) 40 = 18,8 36x + 20 – 40x = 18,8 x = 0,3 (моль CH4 ), т. е. исходная смесь содержала 0,4 мольAl (10,8 г) и 0,2 моль Ca (8 г). 21. В кислороде оба металла сгорают однозначно: 2Mg + O2 = 2MgO; 3Fe + 2O2 = Fe3 O4 Пусть магния было x моль, железа y моль, тогда масса смеси 24x + 56y = 6,24/2 = 3,12; масса продукта сгорания 40x + 232/3 . y = 4,72. Решая систему уравнений, находим x = 0,06 моль магния; y = 0,03 моль железа. В воздухе магний частично реагирует с азотом, образуя нитрид магния: 2Mg + O2 = 2MgO; 3Mg + N2 = Mg3 N2 ; 3Fe + 2O2 = Fe3 O4 Пусть с азотом прореагировало z моль магния, а с кислородом (0,06 – z) моль магния; тогда массу продуктов сгорания можно выразить следующим образом: 4,52 = (0,06 – z) . 40 + z/3. 100 + (232/3). 0,03 MgO Mg3 N2 Fe3 O4 отсюда z = 0,03 моль. Из 0,03 моль магния образуется 0,01 моль нитрида магния, из которого под действием воды выделяется 0,02 моль аммиака: Mg3 N2 + 3H2 O = 3Mg(OH)2 + 2NH3 Объем аммиака V = 0,02 моль . 22,4 л/моль = 0,448 л (н.у.). 22. При сгорании происходят процессы: CH 4 + 2O2 = CO2 + 2H2 O; C2 H2 + 2,5O2 = 2CO2 + H2 O. Соотношение объемов CH4 : CO2 = 1 : 1, а в случае ацетилена – C2 3 = Cr(NO3 )3 + 2AgBr +Ag Предположим, что в смеси было x г CrCl2 и (13,95 – x) г CrBr2 . Считаем реакции протекающими количественно: 123 г CrCl2 при реакции образуют 395 г осадкаAgCl иAg x г CrCl2 при реакции образуют (395/123). x г осадкаAgCl иAg 212 г CrBr2 при реакции образуют 484 г осадкаAgBr иAg (13,95 – x) г при реакции образуют (484/212) . x г осадкаAgBr иAg Составим уравнение: (395/123) . x + 484/212. (13,95 – x) = 32,99, откуда x = 1,23. Итак, в смеси было 1,23 г CrCl2 (0,01 моль) и 12,72 г CrBr2 (0,06 моль). 24. При реакции рубидия с водой выделяется водород и образуется раствор щелочи: Предположим, инерция мышления не позволяет нам вспомнить, что такой раствор реагирует с цинком, тогла путем элементарных расчетов получаем состав смеси: 85,5 % Rb, 14,5 % Zn, и получаем свои 4 балла из 10 по разбалловке. На самом деле цинк растворяется в растворе шелочи: Количество реагирующего цинка определяется количеством гидроксида рубидия, т.е. металлического рубидия в исходной смеси. Цинк прореагирует полностью, если у ≤ 2х. При этом условии состав сплава может быть рассчитан решением системы уравнений: 2 x1 г Rb и у1 г Zn выделяют 1,12 л Н2 , откуда х = 4,275 г Rb и 1,625 г Zn, или в сумме 5,9 г, остальное количество (10 – 5,9 = 4,1) приходится на цинк, оставшийся после реакции (2). Состав сплава – 42,5 % рубидия и 57,25 % цинка. Об оценке неполного ответа, когда не учитывается реакция (2), см. выше.
Поскольку единственное твердое вещество, остающееся после прокаливания, это оксид хрома(III), то можно посчитать, сколько бихромата аммония было в исходной смеси и сколько азота из него получилось: Из 232 г (NH4 )2 Cr2 O7 получается 152 г Cr2 O3 и 22,4 л N2 из x г (NH4 )2 Cr2 O7 –– 15,2 г Cr2 O3 и y л N2 Откуда x = 23,2 г, y = 2,24 л. Приводим задачу к стандартной «задаче на смеси»: вычитаем из общей массы исходной смеси массу бихромата, получаем суммарную массу нитрита и нитрата 54 – 23,2 = 30,3 г. А объем выделившихся при разложении этих двух веществ газов (без воды, т. к. условия нормальные): 11,2 – 2,24 = 8,96 л. Решаем эту стандартную задачу: Пусть нитрита n г, тогда нитрата – (30,3 – n) г. По реакции (1) получится 22,4 . n/54 л азота По реакции (2) получится 44,8 . (30,3 – n)/160 л N2 + 22,4. (30,3 – n)/160 л O2. 27. Реакции гидрирования (цикл гидрируется тоже, поскольку гидрирование «исчерпывающее»): H2 C=C=CH2 + 2H2 = H3 C–CH2 –CH3 H3 C–CH=CH2 + H2 = H3 C–CH2 –CH3 H2 C=CH–CH2 –CH=CH2 + 2H2 = H3 C–CH2 –CH2 –CH2 –CH3 3H2 Пусть в смеси было a моль пропадиена, b моль пропена, c моль пентадиена, в моль винилциклопентена. Тогда количество водорода для полного гидриро- вания: 2a + b + 2c + 3d. По реакциям сжигания, количество образующегося CO2 : 3a + 3b + 5c + 7d. Согласно условию, 2a + b + 2c + 3d = 0,5 . (3a + 3b + 5c + 7d), или 0,5a = 0,5b + 0,5c + 0,5d, или a = b + с + d, т. е. количество a равно количеству остальных компонентов смеси, или 50 мольных %. 28. 26,5% С 5 Н12 и 73% С7 Н16 , либо 79% С6 Н14 и 21% С8 Н18 .
где а – масса CO2 ,b – масса углеводородов Сn H2n+2 и Cn+k H(2n+2k+2) . 29. Строго говоря, задача не является задачей «на смеси». Но, поскольку расчеты все равно параллельные, мы поместили ее в этот раздел. a) Реакция с соляной кислотой: 1,52 – 0,56 = 0,96 г металла прореагировало, 0,896 л Н2 образовалось. Атомная масса металла М = 11,2 . 0,96/0,896n = 12 n г. Возможные решения:
реакция: Si + 2NaOH + H2 O = Na2 SiO3 + 2H2 . в) Взаимодействие элементов друг с другом: 2Mg + Si = Mg2 Si 0,96 г М + 0,56 г Si = 1,52 г силицида Mgx Siy . Массовые доли: w Mg = 0,96/1,52 = 0,63;w Si = 0,56/1,52 = 0,37; x : y = 0,63/24: 0,37/28 = 2 : 1, что подтверждает формулу силицида магния Mg2 Si. г) Реакция силицида с кислотой: Mg2 Si + 4HCl = 2MgCl2 + SiH4 ; 0,02 моль 0,02 моль. д) Реакция силана с кислородом: SiH4 + 2O2 = SiO2 + 2H2 O. Кислорода было 1 литр, или 0,0446 моль. Расход кислорода в реакции – 0,04 моль, т.е. после реакции его осталось 0,0046 моль. Принимаем, что температура неизменна и сопоставляем давление в сосуде до и после реакции:
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Чему бы ты ни учился, ты
учишься для себя.
Петроний
Цели урока:
- познакомить учащихся с основными способами решения задач по химическим уравнениям:
- находить количество, массу и объём продуктов реакции по количеству, массе или объёму исходных веществ,
- продолжить формирование навыков работы с текстом задачи, умение аргументировано выбирать способ решения учебной задачи, умения составлять уравнения химических реакций.
- развивать умения анализировать, сравнивать, выделять главное, составлять план действия, делать выводы.
- воспитывать терпимость к другим, самостоятельность в принятии решений, умение объективно оценить результаты своего труда.
Формы работы: фронтальная, индивидуальная, парная, групповая.
Тип урока: комбинированный с применением ИКТ
I Организационный момент.
Здравствуйте ребята. Сегодня, мы с вами научимся решать задачи по уравнениям химических реакций. Слайд 1 (cм. презентацию).
Цели урока Слайд 2.
II.Актуализация знаний, умений, навыков.
Химия очень интересная и в то же время сложная наука. Для того чтобы знать и понимать химию, надо не только усваивать материал, но и уметь применять полученные знания. Вы узнали какие признаки указывают на протекание химических реакций, научились составлять уравнения химических реакций. Я надеюсь, что вы хорошо усвоили эти темы и без труда ответите на мои вопросы
Какое явление не является признаком химических превращений:
а) появление осадка; в) изменение объема;
б) выделение газа; г) появление запаха. Слайд 3
Укажите цифрами:
а) уравнения реакций соединения
б) уравнения реакций замещения
в) уравнения реакций разложения Слайд 4
Для того, чтобы научиться решать задачи, необходимо составить алгоритм действий, т.е. определить последовательность действий.
Алгоритм для расчета по химическим уравнениям (у каждого учащегося на столе)
5. Записать ответ.
Приступаем к решению задач, применяя алгоритм
Вычисление массы вещества по известной массе другого вещества, участвующего в реакции
Вычислите массу кислорода, выделившегося в результате разложения
порции воды массой 9 г.
Найдем молярную массу воды и кислорода:
М(Н 2 О) = 18 г/моль
М(О 2) = 32 г/моль Слайд 6
Запишем уравнение химической реакции:
2Н 2 О = 2Н 2 + О 2
Над формулой в уравнении реакции запишем найденное
значение количества вещества, а под формулами веществ -
стехиометрические соотношения, отображаемые
0,5моль х моль
2Н 2 О = 2Н 2 + О 2
2моль 1моль
Вычислим количество вещества, массу которого требуется найти.
Для этого составляем пропорцию
0,5моль = хмоль
2моль 1моль
откуда х = 0,25 моль Слайд 7
Следовательно, n(O 2)=0,25 моль
Найдем массу вещества, которую требуется вычислить
m(O 2)= n(O 2)*M(O 2)
m(O 2) = 0,25 моль 32 г/моль = 8 г
Запишем ответ
Ответ: m(О 2) = 8 г Слайд 8
Вычисление объема вещества по известной массе другого вещества, участвующего в реакции
Вычислите объем кислорода (н. у.), выделившегося в результате разложения порции воды массой 9 г.
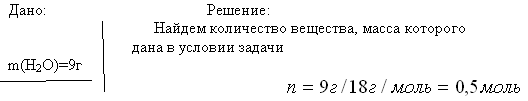
V(0 2)=?л(н.у.)
М(Н 2 О)=18 г/моль
Vm=22,4л/моль Слайд 9
Запишем уравнение реакции. Расставим коэффициенты
2Н 2 О = 2Н 2 + О 2
Над формулой в уравнении реакции запишем найденное значение количества вещества, а под формулами веществ - стехиометрические соотношения, отображаемые химическим уравнением
0,5моль - х моль
2Н 2 О = 2Н 2 + О 2 Слайд10
2моль - 1моль
Вычислим количество вещества, массу которого требуется найти. Для этого составим пропорцию
![]()
откуда х = 0,25 моль
Найдем объем вещества, который требуется вычислить
V(0 2)=n(0 2) Vm
V(O 2)=0,25моль 22,4л/моль=5,6л (н. у.)
Ответ: 5,6 л Слайд 11
III.Закрепление изученного материала.
Задачи для самостоятельного решения:
1.При восстановлении углем оксидов Fe 2 O 3 и SnO 2 получили по 20 г Fe и Sn. Сколько граммов каждого оксида было взято?
2.В каком случае образуется больше воды:
а) при восстановлении водородом 10 г оксида меди (I) (Cu 2 O) или
б) при восстановлении водородом 10 г оксида меди(II) (CuO)? Слайд 12
Проверим решение задачи 1
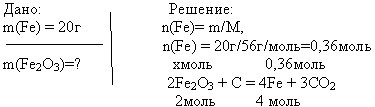
M(Fe 2 O 3)=160г/моль
M(Fe)=56г/моль, ![]()
m(Fe 2 O 3)=, m(Fe 2 O 3)= 0,18*160=28,6г
Ответ: 28,6г
Слайд 13
Проверим решение задачи 2
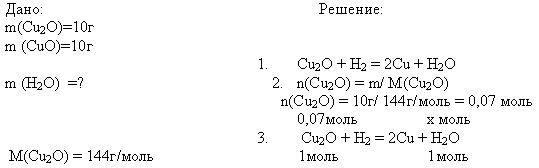
M(CuO) = 80 г/моль
4. ![]()
х моль = 0,07моль,
n(H 2 O)=0,07 моль
m(H 2 O) = 0,07моль*18г/моль=1,26г
Слайд 14
CuO + H 2 = Cu + H 2 O
n(CuO) = m/ M(CuO)
n(CuO) = 10г/ 80г/моль = 0,125 моль
0,125моль хмоль
CuO + H 2 = Cu + H 2 O
1моль 1моль
![]()
х моль = 0,125моль, n(H 2 O)=0,125 моль
m (H 2 O) = n * M(H 2 O);
m(H 2 O) = 0,125моль*18г/моль=2,25г
Ответ: 2,25г Слайд 15
Домашнее задание: изучить материал учебника с. 45-47, решить задачу
Какую массу оксида кальция и какой объм углекислого газа (н.у.)
можно получить при разложении карбоната кальция массой 250г?
CaCO 3 = CaO + CO Cлайд 16.
Литература
1. Габриелян О.С. Программа курса химии для 8-11 классов общеобразовательных учреждений. М. Дрофа 2006г.
2. Габриелян О.С. Химия. 8 класс. Учебник для общеобразовательных учреждений. Дрофа. М. 2005г.
3. Горбунцова С.В. Тесты по основным разделам школьного курса хииии. 8 - 9 классы.ВАКО, Москва,2006г.
4. Горковенко М.Ю.Поурочные разработки по химии. К учебникам О.С.Габриеляна, Л.С.Гузея, В.В.Сорокина, Р.П.Суровцевой и Г.Е.Рудзитиса, Ф.Г.Фельдмана. 8 класс.ВАКО, Москва, 2004г.
5. Габриелян О.С. Химия. 8 класс: Контрольные и проверочные работы. – М.: Дрофа, 2003.
6.Радецкий А.М., Горшкова В.П. Дидактический материал по химии для 8-9 классов: Пособие для учителя. – М.: Просвещение, 2000
Приложение.
Расчеты по химическим уравнениям
Алгоритм действий.
Для того, чтобы решить расчетную задачу по химии, можно воспользоваться следующим алгоритмом – сделать пять шагов:
1. Составить уравнение химической реакции.
2. Над формулами веществ записать известные и неизвестные величины с соответствующими единицами измерения (только для чистых веществ, без примесей). Если по условию задачи в реакцию вступают вещества, содержащие примеси, то сначала нужно определить содержание чистого вещества.
3. Под формулами веществ с известными и неизвестными записать соответствующие значения этих величин, найденные по уравнению реакций.
4. Составить и решить пропорцию.
5. Записать ответ.
Соотношение некоторых физико-химических величин и их единиц
Масса (m) : г; кг; мг
Кол-во в-ва (n) : моль; кмоль; ммоль
Молярная масса (M): г/моль; кг/кмоль; мг/ммоль
Объём (V) : л; м 3 /кмоль; мл
Молярный объём(Vm) : л/моль; м 3 /кмоль; мл/ммоль
Число частиц (N): 6 1023 (число Авагадро – N A); 6 1026 ; 6 1020
Задача 121.
Смешано 7,3г НСI с 4,0г NH
3 . Сколько граммов NH
4 С1 образуется? Найти массу оставшегося после реакции газа.
Решение:
Уравнение реакции имеет вид:
NH 3 + HCl = NH 4 Cl
Молекулярные массы HCl, NH 3 и NH 4 Cl соответственно равны 36,453, 17 и 53,453. Следовательно, их мольные массы составляют 36,453; 17; 53,453г/моль. Согласно уравнению реакции 1 моль HCl реагирует с 1 моль NH 3 , образуя 1 моль NH4Cl. Находим, какое вещество взято в недостатке:
В недостатке взято 0,2 моля HCl, значит, расчёт массы, образовавшейся соли NH 4 Cl, производим по количеству соляной кислоты:
m(NH 4 Cl) = 0,2 . 53,453 = 10,69г.
Затем рассчитаем массу NH3, вступившего в реакцию с HCl:
m(NH 3) = 0,2. 17 = 3,4г.
Ответ: 10,69г NH 4 Cl; 3,4г NH 3 .
Задача 122.
Какой объем воздуха потребуется для сжигания 1м 3 газа, имеющего следующий состав по объему: 50% Н 2 , 35% СН 4 , 8% СО, 2% С 2 Н 4 и 5% негорючих примесей. Объемное содержание кислорода в воздухе равно 21%.
Решение:
Рассчитаем объём кислорода, необходимый для сжигания газов.
а) Уравнение реакции сгорания водорода:
2Н 2 + О 2 = 2Н 2 О
Находим объём водорода, содержащегося в 1м 3 газа из пропорции:
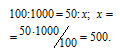
Согласно уравнению реакции на сжигание 2 молей Н 2 расходуется 1 моль О 2 т. е. на сжигание 44,8л водорода требуется 22,4л кислорода.
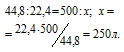
б) Уравнение реакции сгорания метана:
СН 4 + О 2 = СО 2 + 2Н 2 О
Находим объём метана, содержащегося в 1м 3 газа из пропорции:
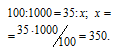
Согласно уравнению реакции на сжигание 1 моль СН 4 расходуется 2 моля О 2 т. е. на сжигание 22,4л метана требуется 44,8л кислорода.
Находим объём расходуемого кислорода из пропорции:
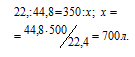
в) Уравнение реакции горения угарного газа:
2CO + O 2 = 2CO 2
Находим объём угарного газа, содержащегося в 1м 3 газа из пропорции:
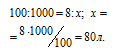
Согласно уравнению реакции на сжигание 2 молей СО расходуется 1 моль О 2 т. е. на сжигание 44,8л угарного газа требуется 22,4л кислорода.
Находим объём расходуемого кислорода из пропорции:
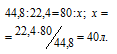
г) Уравнение реакции горения этилена:
C 2 H 4 + 3O 2 = 2CO 2 + 2H 2 O
Согласно уравнению реакции на сжигание 1 моль С 2 Н 4 расходуется 3 моль О 2 , т.е. затрачивается в три раз больший объём кислорода, чем этилена.
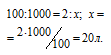
Кислорода для сжигания этилена требуется в три раза больше по объёму, чем этилена, а именно 60л (20 . 3 = 60).
Теперь находим общий объём кислорода, затраченный на сжигание 1м 3 газа:
V(O 2) = 250 + 700 + 40 + 60 = 1050 л.
Рассчитаем объём воздуха, содержащий 1050 л кислорода из пропорции
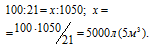
Ответ:
5м 3
Задача 123.
При пропускании водяного пара над раскаленным углем получается водяной газ, состоящий из равных объемов СО и Н 2 . Какой объем водяного газа (условия нормальные) может быть получен из 3,0 кг угля?
Решение:
C(к) + H 2 О(г) = СО(г) + Н 2 (г)
Согласно уравнению реакции из одного моля угля и одного моля воды образуется «водяной газ», состоящий из одного моля угарного газа и одного моля водорода. Мольная масса углерода равна 12 кг/кмоль; 1 кмолоь «водяного газа» занимает объём 44,8м 3 .
Рассчитаем объём водяного газа, образуемого из 3кг угля из пропорции:
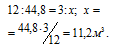
Ответ: 11,2м 3 .
Задача 124.
Карбонат кальция разлагается при нагревании на СаО и СО 2 . Какая масса природного известняка, содержащего 90% (масс.) СаСО 3 , потребуется для получения 7,0т негашеной извести?
Решение:
Уравнение протекающей реакции:
СаСO 3 CaO + CO 2
Молекулярные массы СаСО 3 и СаО соответственно равны 100 и 56, следовательно, их мольные массы составляют 100 и 56г/моль. Согласно уравнению реакции 1 моль СаСО 3 образует 1 моль СаО. Находим теоретический выход негашёной извести из пропорции:
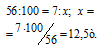
Находим массу природного известняка из пропорции:
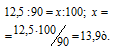
Ответ: 13,9т.
Задача 125.
К раствору, содержащему 6,8г АIСl 3 , прилили раствор, содержащий 5,0г КОН. Найти массу образовавшегося осадка.
Решение:
Уравнение протекающей реакции:
АIСl 3 + 3КОН = Al(OH) 3 ↓ + 3H 2 O
Мольные массы АlCl 3 , KOH и Al(OH)3 соответственно равны 133,34; 56 и 78 г/моль. Рассчитаем количество реагирующих веществ по формуле:
Где n
Отсюда
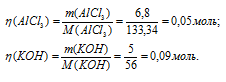
Согласно уравнению реакции 1 моль AlCl 3 реагирует с 3 моль КОН с образованием 1 моль Al(OH) 3 , т.е. КОН должно 0,15 моль (0,05 . 3 = 0,15), чем взято по условию задачи (0,09 моль). Таким образом, КОН взят в недостатке, поэтому расчёт массы Al(OH) 3 проводим по КОН, получим:
![]()
Ответ: 2,3г
Задача 126.
Через раствор, содержащий 7,4г гидроксида кальция, пропустили 3,36л диоксида углерода, взятого при нормальных условиях. Найти массу вещества, образовавшегося в результате реакции.
Решение:
Уравнение реакции имеет вид:
Ca(OH) 2 + CO 2 = CaCO 3 ↓ + H 2 O
Молекулярные массы Са(ОН)2 и СаСО 3 соответственно равны 74 и 100, следовательно, их мольные массы составляют 74 и 100г/моль. Согласно уравнению реакции из 1 моль Са(ОН) 2 и 1 моль СО 2 образуется 1 моль СаСО 3 . Рассчитаем количество реагирующих веществ по формуле
Где n - количество вещества, моль; m(B) – масса вещества, г; M(B) – мольная масса, г/моль.
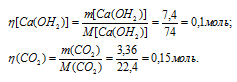
Следовательно, СО 2 взят в избытке и поэтому расчёт массы образовавшегося СаСО 3 будем проводить по Са(ОН) 2 .
m(CaCO 3) = n(CaCO 3) . M(CaCO 3) = 0,1 . 100 = 10г.
Ответ: 10г
3Сu + 8HNO 3 = 3Cu(NO 3) 2 + 2NO + 4H 2 O
Мольные массы Cu и Cu(NO 3) 2 соответственно равны 63,55 и 187,55г/моль. Согласно уравнению реакции из 3 моль Cu образуется 3 моль Cu(NO 3) 2 . Рассчитаем массу Cu(NO 3) 2 , образующуюся при растворении 10г меди в азотной кислоте:
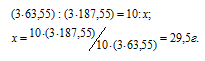
Находим мольную массу кристаллогидрата нитрата меди:
M[(Cu(NO 3) 2) . 3H2O] = 187,55 + (3 . 18) = 214,55г/моль.
Рассчитаем массу образовавшегося кристаллогидрата меди:
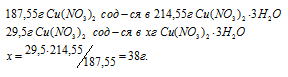
Ответ : 38г
Задача 128.
При обработке раствором гидроксида натрия 3,90г смеси алюминия с его оксидом выделялось 840 мл газа, измеренного при нормальных условиях. Определить процентный состав (по массе) исходной смеси.
Решение:
Уравнения протекающих реакций:
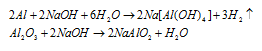
Следовательно, водород образуется при растворении алюминия в растворе щёлочи Согласно уравнению реакции из 2 моль Al (2 . 27 = 54г) образуется 3 моль Н 2 или 67,2л (3 . 22,4 = 67,2). Рассчитаем массу алюминия в смеси из пропорции:
![]()
Теперь находим процентное содержание алюминия в смеси по формуле:
![]()
Где(B) - массовая доля вещества (В) в процентах, %; m(B) - масса вещества (В) в смеси, г; m(смеси) - масса смеси веществ, г.
![]()
Ответ: 17,3%.
Задача 129.
5,10г порошка частично окисленного магния обработали соляной кислотой. При этом выделилось 3,74л Н 2 , измеренного при нормальных условиях. Сколько процентов магния (по массе) содержалось в образце?
Решение:
Уравнение протекающей реакции:
Mg + 2HCl = MgCl 2 + H 2
Мольная масса Mg равна 24,312г/моль, мольный объём газа равен 22,4л/моль. Согласно уравнению реакции 1 моль магния выделяет 1 моль водорода. Рассчитаем массу магния, которая растворилась в кислоте из пропорции:
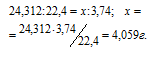
Процентный состав магния в образце определяем из пропорции:
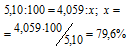
При решении расчетных химических задач необходимо умение производить вычисления по уравнению химической реакции. Урок посвящен изучению алгоритма расчетов массы (объема, количества) одного из участников реакции по известной массе (объему, количеству) другого участника реакции.
Тема: Вещества и их превращения
Урок: Расчеты по уравнению химической реакции
1. Мольные соотношения участников реакции
Рассмотрим уравнение реакции образования воды из простых веществ:
Можно сказать, что из двух молекул водорода и одной молекулы кислорода образуется две молекулы воды. С другой стороны, эта же запись говорит о том, что для образования каждых двух молей воды нужно взять два моля водорода один моль кислорода.
Мольное соотношение участников реакции помогает производить важные для химического синтеза расчеты. Рассмотрим примеры таких расчетов.
2. Задача 1
ЗАДАЧА 1. Определим массу воды, образовавшуюся в результате сгорания водорода в 3,2 г кислорода .
Чтобы решить эту задачу, сначала необходимо составить уравнение химической реакции и записать над ним данные условия задачи.
Если бы мы знали количество вещества вступившего в реакцию кислорода, то смогли бы определить количество вещества воды. А затем, рассчитали бы массу воды, зная ее количество вещества и молярную массу. Чтобы найти количество вещества кислорода, нужно массу кислорода разделить на его молярную массу.
Молярная масса численно равна относительной молекулярной массе. Для кислорода это значение составляет 32. Подставим в формулу: количество вещества кислорода равно отношению 3,2 г к 32 г/моль. Получилось 0,1 моль.
Для нахождения количества вещества воды оставим пропорцию, используя мольное соотношение участников реакции:
на 0,1 моль кислорода приходится неизвестное количество вещества воды, а на 1 моль кислорода приходится 2 моля воды.
Отсюда количество вещества воды равно 0,2 моль.
Чтобы определить массу воды, нужно найденное значение количества воды умножить на ее молярную массу, т. е. умножаем 0,2 моль на 18 г/моль, получаем 3,6 г воды.
Рис. 1. Оформление записи краткого условия и решения Задачи 1
Помимо массы, можно рассчитывать объем газообразного участника реакции (при н. у.), используя известную вам формулу, в соответствие с которой объем газа при н. у. равен произведению количества вещества газа на молярный объем. Рассмотрим пример решения задачи.
3. Задача 2
ЗАДАЧА 2. Рассчитаем объем кислорода (при н. у.), выделившийся при разложении 27г воды.
Запишем уравнение реакции и данные условия задачи. Чтобы найти объем выделившегося кислорода, нужно найти сначала количество вещества воды через массу, затем по уравнению реакции определить количество вещества кислорода, после чего можно рассчитать его объем при н. у.
Количество вещества воды равно отношению массы воды к ее молярной массе. Получаем значение 1,5 моль.
Составим пропорцию: из 1,5 моля воды образуется неизвестное количество кислорода, из 2 молей воды образуется 1 моль кислорода. Отсюда количество кислорода равно 0,75 моля. Рассчитаем объем кислорода при н. у. Он равен произведению количества кислорода на молярный объем. Молярный объем любого газообразного вещества при н. у. равен 22,4 л/моль. Подставив числовые значения в формулу, получим объем кислорода, равный 16,8 л.

Рис. 2. Оформление записи краткого условия и решения Задачи 2
Зная алгоритм решения подобных задач, можно рассчитать массу, объем или количество вещества одного из участников реакции по массе, объему или количеству вещества другого участника реакции.
1. Сборник задач и упражнений по химии: 8-й кл.: к учеб. П. А. Оржековского и др. «Химия. 8 класс» / П. А. Оржековский, Н. А. Титов, Ф. Ф. Гегеле. - М.: АСТ: Астрель, 2006. (с.40-48)
2. Ушакова О. В. Рабочая тетрадь по химии: 8-й кл.: к учебнику П. А. Оржековского и др. «Химия. 8 класс» / О. В. Ушакова, П. И. Беспалов, П. А. Оржековский; под. ред. проф. П. А. Оржековского - М.: АСТ: Астрель: Профиздат, 2006. (с. 73-75)
3. Химия. 8 класс. Учеб. для общеобр. учреждений / П. А. Оржековский, Л. М. Мещерякова, М. М. Шалашова. - М.:Астрель, 2013. (§23)
4. Химия: 8-й класс: учеб. для общеобр. учреждений / П. А. Оржековский, Л. М. Мещерякова, Л. С. Понтак. М.: АСТ: Астрель, 2005. (§29)
5. Химия: неорган. химия: учеб. для 8кл. общеобр. учрежд. /Г. Е. Рудзитис, Ф. Г. Фельдман. - М.: Просвещение, ОАО «Московские учебники», 2009. (с.45-47)
6. Энциклопедия для детей. Том 17. Химия / Глав. ред. В.А. Володин, вед. науч. ред. И. Леенсон. - М.: Аванта+, 2003.
Дополнительные веб-ресурсы
1. Тесты по химии (онлайн) .
2. Единая коллекция цифровых образовательных ресурсов.
Домашнее задание
1) с. 73-75 №№ 2, 3, 5 из Рабочей тетради по химии: 8-й кл.: к учебнику П. А. Оржековского и др. «Химия. 8 класс» / О. В. Ушакова, П. И. Беспалов, П. А. Оржековский; под. ред. проф. П. А. Оржековского - М.: АСТ: Астрель: Профиздат, 2006.
2) с.135 №№ 3,4 из учебника П. А. Оржековского, Л. М. Мещеряковой, М. М. Шалашовой «Химия: 8кл.», 2013 г.
Возможно, будет полезно почитать:
- Патриарх кирилл запретил актеру и священнику ивану охлобыстину служить в церкви Охлобыстин церковный сан ;
- Иван охлобыстин - биография, информация, личная жизнь Почему охлобыстин ушел из священников ;
- Ужин для ребенка 4 лет рецепты меню ;
- Принципы функционирования бюджетной системы РФ ;
- Особенности размещения населения на территории земли Население земли размещается равномерно средняя плотность населения ;
- Тонька-пулеметчица — cтрашная судьба страшного человека Фильм палач тонька пулеметчица реальная история ;
- Как поздравить начальницу с юбилеем? ;
- Российские студенты выиграли чемпионат мира по программированию Вот они, герои ;