В гидроксид оксида серы 4 связи. Сернистый газ. Формула, получение, химические свойства. Сернистый газ в природе
Оксид серы (сернистый газ, серы диоксид, ангидрид сернистый) - это бесцветный газ, имеющий в в нормальных условиях резкий характерный запах (похож на запах загорающейся спички). Сжижается под давлением при комнатной температуре. Сернистый газ растворим в воде, при этом образуется нестойкая серная кислота. Также это вещество растворяется в серной кислоте и этаноле. Это один из основных компонентов, входящих в состав вулканических газов.
Демонстрирующий синергизм у этого самого носоглоточного животного, проводили при относительной влажности около 50%, которая ниже точки разложения хлорида натрия; это может быть объяснено тем фактом, что диоксид серы все еще может быть поглощен сухими частицами, хотя и в меньшей степени.
Другие исследования Амдура и ее коллег по гунайской свиньи, оценивающие серию различных инертных аэрозолей, вдыхаемых в сочетании с диоксидом серы, показали, что размер частиц имеет большое значение; что потенцирование наблюдается только при использовании растворимых аэрозолей; что растворимые металлические аэрозоли оказывают большее влияние, чем инертные аэрозоли, по-видимому, из-за каталитического образования серной кислоты; и что влияние смесей аэрозолей и диоксида серы имеет тенденцию к сохранению, в то время как влияние двуокиси серы быстро исчезает.
Сернистый газ
Получение SO2 - диоксида серы - промышленным способом заключается в сжигании серы или обжиге сульфидов (используется в основном пирит).
4FeS2 (пирит) + 11O2 = 2Fe2O3 + 8SO2 (сернистый газ).
В условиях лаборатории сернистый газ можно получить путем воздействия сильных кислот на гидросульфиты и сульфиты. При этом получившаяся сернистая кислота сразу распадается на воду и сернистый газ. Например:
Сернистый газ — получение в лаборатории и в промышленности
Эта модель морской свинки также использовалась для изучения влияния других оксидов серы. Аэрозоли серной кислоты гораздо более эффективны, чем диоксид серы, при увеличении сопротивления легочному течению, и реакция быстрее и длительна. Серная кислота также более эффективна, чем комбинированное воздействие двуокиси серы и аэрозоля хлорида натрия, особенно при низких концентрациях. Размер аэрозоля серной кислоты влиял на степень увеличения сопротивления легочному течению, ход реакции и степень обструкции дыхательных путей.
Na2SO3 + H2SO4 (серная кислота) = Na2SO4 + H2SO3 (сернистая кислота).
H2SO3 (сернистая кислота) = H2O (вода) + SO2 (сернистый газ).
Третий способ получения сернистого ангидрида заключается в воздействии концентрированной серной кислоты при нагревании на малоактивные металлы. Например: Cu (медь) + 2H2SO4 (серная кислота) = CuSO4 (сульфат меди) + SO2 (диоксид серы) + 2H2O (вода).
Сообщалось также о синергизме между двуокисью серы и аэрозолем серной кислоты на устойчивость к легочным кровотокам у морских свинок. Было обнаружено, что кратковременное вдыхание аэрозолей различных сульфатов в виде частиц повышает устойчивость к легочным потокам при концентрациях, при которых инертные аэрозоли не оказывают никакого эффекта. Сульфат цинка аммония был более сильным, чем сульфат цинка или аммоний.
Сульфат; это говорит о важности кислотности аэрозоля. Однако сульфат аммония оказывал меньшее влияние, чем сульфат цинка. Опять же, токсичность обратно пропорциональна размеру частиц. Было обнаружено, что только вдыхаемый сульфат железа увеличивает сопротивление легочному потоку, но сульфат железа не имеет никакого эффекта.
Химические свойства диоксида серы
Формула сернистого газа - SO3. Это вещество относится к кислотный оксидам.
1. Диоксид серы растворяется в воде, при этом образуется сернистая кислота. В обычных условиях данная реакция обратима.
SO2 (диоксид серы) + H2O (вода) = H2SO3 (сернистая кислота).
2. С щелочами диоксид серы образует сульфиты. Например: 2NaOH (гидроксид натрия) + SO2 (сернистый газ)= Na2SO3 (сульфит натрия) + H2O (вода).
Только последнее соединение вызывало сенсорное раздражение, с эффектами, аналогичными эффектам двуокиси серы. Авторы предполагают, что образование бисульфита в слабощелочной слизистой носа является центральным механизмом действия. Амдер обобщил свои исследования на морских свинках и подготовил кривые зависимости доза-эффект, сравнивая влияние различных оксидов серы. Данные ясно показывают, что двуокись серы гораздо менее раздражает, чем эквивалентные концентрации серной кислоты и сульфата цинка аммония.
Относительная токсичность последних двух соединений зависит от размера частиц. В некоторых случаях сульфат цинка аммония, по-видимому, более эффективен, чем серная кислота. Эти данные подчеркивают необходимость точного определения состава и размера частиц в загрязненном воздухе. В общем, данные показывают, что атмосферное окисление относительно небольшой доли двуокиси серы будет приводить к образованию более токсичных аэрозолей в виде частиц, чем исходный газ. Кроме того, воздействие двуокиси серы и ее продуктов, вероятно, является аддитивным и, возможно, синергетическим.
3. Химическая активность сернистого газа достаточно велика. Наиболее выражены восстановительные свойства сернистого ангидрида. В таких реакциях степень окисления серы повышается. Например: 1) SO2 (диоксид серы) + Br2 (бром) + 2H2O (вода) = H2SO4 (серная кислота) + 2HBr (бромоводород); 2) 2SO2 (диоксид серы) + O2 (кислород) = 2SO3 (сульфит); 3) 5SO2 (диоксид серы) + 2KMnO4 (перманганат калия) + 2H2O (вода) = 2H2SO4 (серная кислота) + 2MnSO4 (сульфат марганца) + K2SO4 (сульфат калия).
Человек был предметом ряда контролируемых экспериментальных исследований острых эффектов двуокиси серы. Повышенное сопротивление дыхательных путей, обусловленное, по-видимому, бронхоконстрикцией, является главной особенностью. Реакция на двуокись серы. Недавние исследования Андерсена и др. демонстрируя, что концентрации диоксида серы, приводящие к увеличению объема принудительного выдоха, не влияют на объем закрытия дыхательных путей, указывают на то, что затронуты только относительно большие части бронхов.
Растворимость и взаимодействие с водой
Повышенное сопротивление потоку дыхательных путей также наблюдается вследствие воздействия очень высоких концентраций частиц. Этот эффект двуокиси серы быстро обратим и, как и у животных, оказывается опосредованным через дуги редукции блуждающего нерва. Вдыхание через нос, по-видимому, вызывает меньший отклик, чем ингаляция через рот, но опять-таки есть какая-то изменчивость в результатах. В некоторых случаях реакция на диоксид серы, по-видимому, уменьшается при длительном или последующем воздействии.
Последняя реакция - это пример качественной реакции на SO2 и SO3. Происходит обесцвечивание раствора фиолетового цвета).
4. В условиях присутствия сильных восстановителей сернистый ангидрид может проявлять свойства окислительные. Например, для того чтобы в металлургической промышленности извлечь серу из отходящих газов, используют восстановление диоксида серы оксидом углерода (CO): SO2 (диоксид серы) + 2CO (оксид углерода) = 2CO2 + S (сера).
Практическое использование сернистого газа
Интересная серия исследований была представлена Вейром и Бромбергом. Попытки продемонстрировать синергетический эффект двуокиси серы и аэрозоля хлорида натрия у человека оказались безуспешными. Присадочный эффект комбинированного воздействия диоксида серы и азота. Диоксид.
Большой интерес представляет недавнее исследование Бейтса и Хазуки, которое продемонстрировало синергетический эффект двуокиси серы и озона у здоровых мужчин. Никаких изменений в функции легких не наблюдалось у добровольцев, которые в течение 2 часов дышали только двуокисью серы на 37 млн. Только озон в этой концентрации имел гораздо меньший эффект.
Также окислительные свойства этого вещества используют в целях получения фосфорноваристой ксилоты: PH3 (фосфин) + SO2 (сернистый газ) = H3PO2 (фосфорноваристая кислота) + S (сера).
Где применяют сернистый газ
В основном диоксид серы используют для получения кислоты серной. Также его применяют как в производстве слабоалкогольных напитков (вино и другие напитки средней ценовой категории). Благодаря свойству этого газа убивать различные микроорганизмы, им окуривают складские помещения и овощехранилища. Помимо этого, оксид серы используют для отбеливания шерсти, шелка, соломы (тех материалов, которые нельзя отбелить хлором). В лабораториях сернистый газ применяют в качестве растворителя и в целях получения различных солей кислоты сернистой.
Поскольку это самая низкая концентрация двуокиси серы, которая, как сообщается, оказывает влияние на человека, результаты показывают, что физические нагрузки усиливают действие двуокиси серы, возможно, благодаря увеличению скорости дыхания и вдоха. Существует ряд возможных объяснений наблюдаемого синергизма между озоном и двуокисью серы. Вероятнее всего, серная кислота была образована реакцией этих двух агентов в присутствии водяного пара или слизи в дыхательных путях. Также возможно, что, уменьшая рН слизистой оболочки, диоксид серы увеличивает растворимость озона и тем самым усиливает озоновый эффект.
Физиологическое воздействие
Сернистый газ обладает сильными токсическими свойствами. Симптомы отравления - это кашель, насморк, охриплость голоса, своеобразный привкус во рту, сильное першение в горле. При вдыхании диоксида серы в высоких концентрациях возникает затруднение глотания и удушье, расстройство речи, тошнота и рвота, возможно развитие острого отека легких.
Необходимы дальнейшие исследования этого важного наблюдения, в частности, чтобы исключить возможность образования в камере аэрозоля с серной кислотой. Пэтт и его коллеги выставили здоровых добровольцев на серную кислоту. При высоких концентрациях, используемых в их экспериментах, наблюдалось заметное увеличение сопротивления дыхательных путей, как и дискомфорт в грудной клетке, хрипы, кашель и слезотечение. Два субъекта, которые периодически подвергались воздействию, проявляли симптомы бронхита. Присутствие водяного пара усиливало наблюдаемые реакции, но добавление паров аммиака уменьшало эффект.
ПДК сернистого газа:
- в помещении - 10 мг/м³;
- среднесуточная максимально-разовая в атмосферном воздухе - 0,05 мг/м³.
Чувствительность к диоксиду серы у отдельных людей, растений и животных различна. Например, среди деревьев наиболее устойчивы дуб и береза, а наименее - ель и сосна.
Сернистый газ имеет молекулярное строение, аналогичное озону. Атом серы, находящийся в центре молекулы, связан с двумя атомами кислорода. Этот газообразный продукт окисления серы не имеет цвета, издает резкий запах, при изменении условий легко конденсируется в прозрачную жидкость. Вещество хорошо растворимо в воде, обладает антисептическими свойствами. В больших количествах получают SO 2 в химической промышленности, а именно в цикле сернокислотного производства. Газ широко используется для обработки сельскохозяйственных и пищевых продуктов, отбеливания тканей в текстильной промышленности.
Последнее открытие предполагает, что сульфат аммония не так токсичен, как серная кислота. Ряд исследователей изучили влияние кратковременного воздействия диоксида серы на различные аспекты мукоцилиарного транспорта. Сообщается о снижении цилиарной активности в трахеях кроликов после ингаляции или прямого воздействия трахеи. Этот эффект не усиливался, когда в него вдыхали частицы углерода, способные поглощать диоксид серы. В последнем исследовании краткосрочные экспозиции с высокой дозой имели меньший эффект, чем долгосрочные воздействия низких доз.
Систематические и тривиальные названия вещества
Необходимо разобраться в многообразии терминов, относящихся к одному и тому же соединению. Официальное название соединения, химический состав которого отражает формула SO 2 , — диоксид серы. ИЮПАК рекомендует использовать этот термин и его английский аналог — Sulfur dioxide. Учебники для школ и ВУЗов чаще упоминают еще такое название — оксид серы (IV). Римской цифрой в скобках обозначена валентность атома S. Кислород в этом оксиде двухвалентен, а окислительное число серы +4. В технической литературе используются такие устаревшие термины, как сернистый газ, ангидрид сернистой кислоты (продукт ее дегидратации).
Субъекты, у которых первоначально были самые низкие скорости потока носа, больше всего страдали от двуокиси серы. Снижение расхода было наиболее заметным в передней части носа, которое поглощало основную часть двуокиси серы. Повышенное сопротивление носовому потоку наблюдалось также у всех испытуемых. Исследования долгосрочных эффектов двуокиси серы у животных обычно не проявляли вредных эффектов при концентрациях в пределах обычных условий окружающей среды. Хроническая ингаляция концентраций более 100 м.д. привела к гиперплазии клеток, секретирующих слизь, и метаплазии бронхиального эпителия, подобной таковой при хронических бронхитах у человека.
Состав и особенности молекулярного строения SO 2
Молекула SO 2 образована одним атомом серы и двумя атомами кислорода. Между ковалентными связями имеется угол, составляющий 120°. В атоме серы происходит sp2-гибридизация — выравниваются по форме и энергии облака одного s и двух p-электронов. Именно они участвуют в образовании ковалентной связи между серой и кислородом. В паре О—S расстояние между атомами составляет 0,143 нм. Кислород более электроотрицательный элемент, чем сера, значит, связывающие пары электронов смещаются от центра к внешним углам. Вся молекула тоже поляризована, отрицательный полюс — атомы О, положительный — атом S.
Другие исследования, проведенные той же группой, не показали влияния двуокиси серы на морских свинок, облученных в течение года до аналогичных концентраций. Кроме того, никаких побочных эффектов у морских свинок и обезьян, подвергшихся воздействию золы-летучей золы, вдыхаемой двуокисью серы, не было отмечено в тех же концентрациях и продолжительности, что и в вышеприведенных экспериментах.
Сообщалось, что вдыхание диоксида серы, кукурузного крахмала и частиц кукурузной пыли оказывает влияние на свиней, подобных тем, которые имеют только диоксид серы. Эти исследования были проведены у здоровых животных и не могли имитировать долгосрочные эффекты двуокиси серы на людей с хроническими заболеваниями легких. Однако не было обнаружено, что производство болезней легких путем лечения хомячков папаином или облучения собак диоксидом азота не способствовало усилению реакции на последующее воздействие диоксида серы в очень высоких концентрациях.
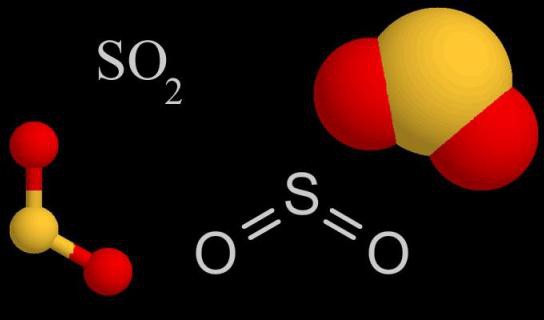
Некоторые физические параметры диоксида серы
Оксид четырехвалентной серы при обычных показателях окружающей среды сохраняет газообразное агрегатное состояние. Формула сернистого газа позволяет определить его относительную молекулярную и молярную массы: Mr(SO 2) = 64,066, М = 64,066 г/моль (можно округлять до 64 г/моль). Этот газ почти в 2,3 раза тяжелее воздуха (М(возд.) = 29 г/моль). Диоксид обладает резким специфическим запахом горящей серы, который трудно перепутать с каким-либо другим. Он неприятный, раздражает слизистые покровы глаз, вызывает кашель. Но оксид серы (IV) не такой ядовитый, как сероводород.
Кроме того, животные, хронически подверженные воздействию воздуха в Лос-Анджелесе, реагировали аналогично чистым воздуховодам при остром воздействии диоксида серы. Было проведено меньше исследований долгосрочного воздействия серной кислоты. При более высоких концентрациях патологические данные зависели от размера частиц.
Серной кислоты в течение 78 недель. Основные наблюдения включали изменения в распределении вентиляции, гиперплазии бронхиального эпителия и утолщении бронхиолярных стенок. Размер частиц, по-видимому, не имел никакого отношения к возможному повреждению, хотя была тенденция к снижению побочных эффектов с частицами в меньшем диапазоне.
Под давлением при комнатной температуре газообразный сернистый ангидрид сжижается. При низких температурах вещество находится в твердом состоянии, плавится при -72…-75,5 °C. При дальнейшем повышении температуры появляется жидкость, а при -10,1 °C вновь образуется газ. Молекулы SO 2 являются термически устойчивыми, разложение на атомарную серу и молекулярный кислород происходит при очень высоких температурах (около 2800 ºС).
Льюис и его коллеги провели серию исследований в области биглей, которые включали индивидуальное или комбинированное воздействие диоксида серы и серной кислоты на срок до 5 лет. Смесь диоксида серы и серной кислоты приводила к физиологическим изменениям, которые предполагали как паренхиматозное заболевание легких, так и обструкцию дыхательных путей. Одновременно только серная кислота уменьшала способность к диффузии легких; только двуокись серы привела к увеличению устойчивости к дыхательным путям и изменениям в отношении легких, аналогичным тем, которые были зарегистрированы у других животных.

Растворимость и взаимодействие с водой
Диоксид серы при растворении в воде частично взаимодействует с ней с образованием очень слабой сернистой кислоты. В момент получения она тут же разлагается на ангидрид и воду: SO 2 + Н 2 О ↔ Н 2 SO 3 . На самом деле в растворе присутствует не сернистая кислота, а гидратированные молекулы SO 2 . Газообразный диоксид лучше взаимодействует с прохладной водой, его растворимость понижается с повышением температуры. При обычных условиях может раствориться в 1 объеме воды до 40 объемов газа.
В одном из исследований гончие, которые ранее подвергались хроническому воздействию диоксида азота, как правило, имели несколько меньшую реакцию на оксиды серы; это говорит о том, что ранее существовавшие изменения в легких были защитными. Дополнительные исследования этой группы дали наводящие на размышления, но не убедительные доказательства того, что вдыхание смесей двуокиси серы и серной кислоты потенцирует легочную гиперинфляцию, вызванную хронической ингаляцией сырого автомобильного выхлопа, и может привести к некоторым сердечным нарушениям.
Сернистый газ в природе
Значительные объемы диоксида серы выделяются с вулканическими газами и лавой во время извержений. Многие виды антропогенной деятельности тоже приводят к повышению концентрации SO 2 в атмосфере.

Сернистый ангидрид поставляют в воздух металлургические комбинаты, где не улавливаются отходящие газы при обжиге руды. Многие виды топливных ископаемых содержат серу, в результате значительные объемы диоксида серы выделяется в атмосферный воздух при сжигании угля, нефти, газа, полученного из них горючего. Сернистый ангидрид становится токсичным для человека при концентрации в воздухе свыше 0,03 %. У человека начинается одышка, могут наступить явления, напоминающие бронхит и воспаление легких. Очень высокая концентрация в атмосфере диоксида серы может привести к сильному отравлению или летальному исходу.
Сернистый газ — получение в лаборатории и в промышленности
Лабораторные способы:
- При сжигании серы в колбе с кислородом или воздухом получается диоксид по формуле: S + O 2 = SO 2 .
- Можно подействовать на соли сернистой кислоты более сильными неорганическими кислотами, лучше взять соляную, но можно разбавленную серную:
- Na 2 SO 3 + 2HCl = 2NaCl + H 2 SO 3 ;
- Na 2 SO 3 + H 2 SO 4 (разб.) = Na 2 SO 4 + H 2 SO 3 ;
- H 2 SO 3 = Н 2 О + SO 2 .
3. При взаимодействии меди с концентрированной серной кислотой выделяется не водород, а диоксид серы:
2H 2 SO 4 (конц.) + Cu = CuSO 4 + 2H 2 O + SO 2 .
Современные способы промышленного производства сернистого ангидрида:
- Окисления природной серы при ее сжигании в специальных топках: S + О 2 = SO 2 .
- Обжиг железного колчедана (пирита).
Основные химические свойства диоксида серы
Сернистый газ является активным соединением в химическом плане. В окислительно-восстановительных процессах это вещество чаще выступает в качестве восстановителя. Например, при взаимодействии молекулярного брома с диоксидом серы продуктами реакции являются серная кислота и бромоводород. Окислительные свойства SO 2 проявляются, если пропускать этот газ через сероводородную воду. В результате выделяется сера, происходит самоокисление-самовосстановление: SO 2 + 2H 2 S = 3S + 2H 2 O.
Диоксид серы проявляет кислотные свойства. Ему соответствует одна из самых слабых и неустойчивых кислот — сернистая. Это соединение в чистом виде не существует, обнаружить кислотные свойства раствора диоксида серы можно с помощью индикаторов (лакмус розовеет). Сернистая кислота дает средние соли - сульфиты и кислые — гидросульфиты. Среди них встречаются стабильные соединения.
Процесс окисления серы в диоксиде до шестивалентного состояния в ангидриде серной кислоты — каталитический. Получившееся вещество энергично растворяется в воде, реагирует с молекулами Н 2 О. Реакция является экзотермической, образуется серная кислота, вернее, ее гидратированная форма.
Практическое использование сернистого газа
Основной способ промышленного производства серной кислоты, для которого нужен диоксид элемента, насчитывает четыре стадии:
- Получение сернистого ангидрида при сжигании серы в особых печах.
- Очищение полученного диоксида серы от всевозможных примесей.
- Дальнейшее окисление до шестивалентной серы в присутствии катализатора.
- Абсорбция триоксида серы водой.
Ранее почти всю двуокись серы, необходимую для производства серной кислоты в промышленных масштабах, получали при обжиге пирита как побочный продукт сталеплавильного производства. Новые виды переработки металлургического сырья меньше используют сжигание руды. Поэтому основным исходным веществом для сернокислотного производства в последние годы стала природная сера. Значительные мировые запасы этого сырья, его доступность позволяют организовать широкомасштабную переработку.

Диоксид серы находит широкое применение не только в химической промышленности, но и в других отраслях экономики. Текстильные комбинаты используют это вещество и продукты его химического взаимодействия для отбеливания шелковых и шерстяных тканей. Это один из видов бесхлорного отбеливания, при котором волокна не разрушаются.
Диоксид серы обладает отличными дезинфицирующими свойствами, что находит применение в борьбе с грибками и бактериями. Сернистым ангидридом окуривают хранилища сельскохозяйственной продукции, винные бочки и подвалы. Используется SO 2 в пищевой промышленности как консервирующее и антибактериальное вещество. Добавляют его в сиропы, вымачивают в нем свежие плоды. Сульфитизация
сока сахарной свеклы обесцвечивает и обеззараживает сырье. Консервированные овощные пюре и соки тоже содержат диоксид серы в качестве антиокислительного и консервирующего агента.
Возможно, будет полезно почитать:
- Патриарх кирилл запретил актеру и священнику ивану охлобыстину служить в церкви Охлобыстин церковный сан ;
- Иван охлобыстин - биография, информация, личная жизнь Почему охлобыстин ушел из священников ;
- Ужин для ребенка 4 лет рецепты меню ;
- Принципы функционирования бюджетной системы РФ ;
- Особенности размещения населения на территории земли Население земли размещается равномерно средняя плотность населения ;
- Тонька-пулеметчица — cтрашная судьба страшного человека Фильм палач тонька пулеметчица реальная история ;
- Как поздравить начальницу с юбилеем? ;
- Российские студенты выиграли чемпионат мира по программированию Вот они, герои ;
